Метою даного дослідження було визначення безпеки та ефективності рекомбінантного тромбопоетину людини (рЧТП) для лікування імунної тромбоцитопенії (ІТП) в період вагітності. У дослідження були включені вагітні пацієнти з ІТП, у яких кількість тромбоцитів становила менше 30х109/л, виявлялась кровотеча, була відсутня реакція на кортикостероїди і/або внутрішньовенний імуноглобулін (ВВІГ), і розвинулася рефрактерність до переливання тромбоцитарної маси. Тридцять один пацієнт отримав рЧТП в початковій дозі 300 Од/кг щодня протягом 14 днів. У двадцяти трьох пацієнтів відзначалася реакція у відповідь на лікування (74,2%), у тому числі 10 пацієнтів з повною відповідною реакцією (> 100х109/л) і 13 пацієнтів з реакцією (30-100х109/л). По всій видимості, рЧТП значно припиняв симптоми кровотечі, навіть у пацієнтів з відсутністю реакції на лікування. рЧТП добре переносився пацієнтами. Запаморочення, втома та біль в місці ін’єкції відзначалися по 1 пацієнту для кожного симптому. У немовлят не спостерігалися вроджені захворювання або затримки в розвитку в середньому періоді подальшого спостереження протягом 53 (інтервал від 39 до 68) тижнів. Насамкінець, рЧТП є потенційно безпечним і ефективним вибором лікування для пацієнтів з ІТП під час вагітності. Наша робота проклала шлях для подальшого вивчення клінічного застосування рЧТП й інших тромбопоетичних агентів для лікування ІТП під час вагітності. Це дослідження зареєстровано на сайті clinicaltrials.gov під номером NCT02391272 (Журнал Blood 2017, 130 (9): 1097-1103).
Ключевые моменты
- рЧТП (рекомбинантный тромбопоэтин человека) – потенциально эффективный и безопасный вариант лечения ИТП во время беременности
Введение
Иммунная тромбоцитопения (ИТП) – приобретенное аутоиммунное заболевание характеризующееся временным или постоянным уменьшением количества тромбоцитов.1
Как увеличение разрушения тромбоцитов, вызванное аутоантителами к гликопротеиновой оболочке тромбоцитов, так и недостаточная выработка тромбоцитов, имеют отношение к ИТП.2-6 ИТП является общей причиной тромбоцитопении в период ранней беременности,7 на фоне 5% всех случаев тромбоцитопении у беременных женщин.8-10 Пациенты с тяжелой формой тромбоцитопении (количество тромбоцитов составляет < 20 х 109/л) подвержены риску спонтанного кровотечения, послеродового кровотечения и отслойки плаценты.8
Аутоантитела к тромбоцитам типа IgG могут проходить через плацентарный барьер и привести к фетальной или преходящей неонатальной тромбоцитопении. От 8,9% до 14,7% новорожденных у беременных женщин с ИТП имеют тяжелую форму тромбоцитопении, а частота внутричерепного кровоизлияния (ВЧК) составляет около 1,5% .11
Подобно небеременным взрослым пациентам с ИТП, первоочередное лечение включает кортикостероиды и внутривенный иммуноглобулин (ВВИГ).
В недавнем ретроспективном исследовании Sun et al. сообщалось, что процент положительного клинического ответа у беременных пациентов с ИТП на ВВИГ либо кортикостероиды составлял менее 40% и мог быть еще ниже, чем у небеременных пациентов.12
Варианты вспомогательного лечения в этом случае ограничены, если у пациентов отсутствует положительная реакция на первичные методы лечения.
Рекомбинантный тромбопоэтин человека (рЧТП) представляет собой гликозилированный тромбопоэтин полной длины с молекулярной массой 90 000 дальтон, синтезируемый в клетках яичника китайского хомячка и очищенную с использованием методов биоинженерии. рЧТП представляет собой рекомбинантную форму c-Mpl лиганда. Он поддерживает аминокислотную последовательность, идентичную эндогенному ТПО, но в последующем гликозилированную.13 Было доказано, что он активен как для моделей человека, так и животного.14,15 рЧТП был одобрен Государственным управлением по контролю качества медикаментов и продуктов питания Китая для лечения хронической ИТП резистентной к первоочередной терапии. Многоцентровое рандомизированное исследование показало, что рЧТП быстро увеличивал количество тромбоцитов с общим процентом положительного клинического ответа 60,3% у пациентов со стероид-резистентным ИТП.14 Однако рЧТП не испытывался для лечения пациентов с ИТП во время беременности. Здесь мы провели проспективное многоцентровое открытое исследование для изучения возможности клинического применения рЧТП для лечения ИТП во время беременности.
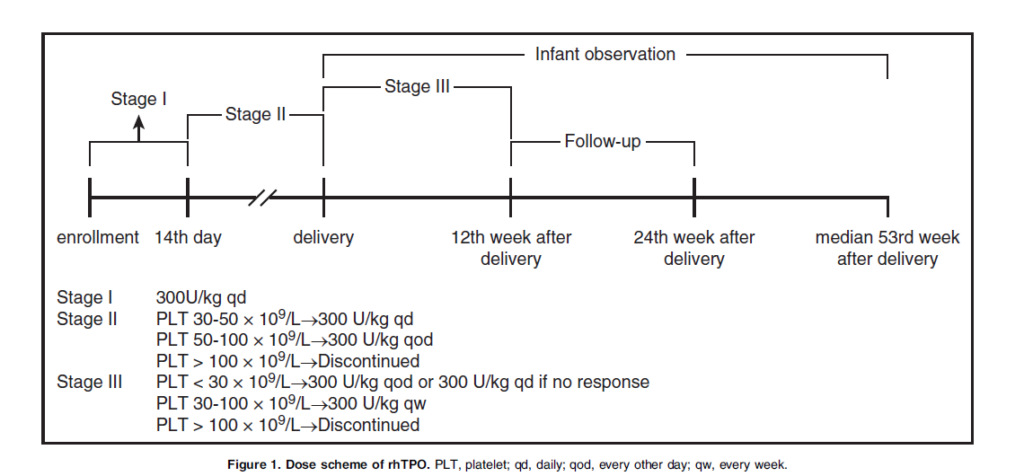
Рис. 1. Схема дозировки рЧТП.
Методы
План клинического исследования
Целью этого многоцентрового открытого несравнительного исследования является определение безопасности и эффективности рЧТП у кортикостероид/ВВИГ-резистентных пациентов с ИТП во время беременности. В этом исследовании приняли участие восемь больниц в Китае. Протокол был одобрен комитетами по этике всех участвующих больниц. Информированное согласие было получено от каждого пациента в соответствии с Хельсинкской декларацией. Все авторы имеют полный доступ к основным данным клинических испытаний.
Пациенты
В исследование были включены пациенты из 8 центров в Китае. Подтверждение и переподтверждение диагноза ИТП основывалось на международном консенсусном докладе об изучении и лечении первичной иммунной тромбоцитопении11 и консенсусе китайских экспертов по диагностике и лечению первичной иммунной тромбоцитопении у взрослых (версия 2016).16 Критерии отбора включали беременных женщин от 18 до 50 лет с симптомами проявления кровотечения и отсутствием положительного ответа на кортикостероиды и/или ВВИГ (могли быть со стабильной дозой кортикостероидов при отборе), а также с рефрактерностью к переливанию тромбоцитарной массы. Пациенты, у которых 2 последовательные скорректированные приросты тромбоцитов через час после переливания составляли менее 10х109/л, считались такими, у которых есть рефрактерность тромбоцитов. Количество тромбоцитов у пациентов было ниже 30 х 109/л. Внутриутробный возраст плода был больше 12 недель.
Исключались пациенты со следующими состояниями или диагнозами: вирус-индуцированная тромбоцитопения; функциональные нарушения сердца, почек, печени или легких; тяжелый иммунодефицит; другие аутоиммунные заболевания, положительные антиядерные антитела, анти-кардиолипиновые антитела, волчаночный антикоагулянт или прямая проба Кумбса. Также исключались пациенты, которые получали химиотерапию или антикоагулянты в течение 3 месяцев до скрининга или другую специальную вторичную терапию ИТП в течение 3 месяцев до скрининга.
Процедуры
Все подходящие участники получали рЧТП в начальной дозе 300 ед/кг один раз в день подкожным введением в течение 14 дней, а затем получали последовательную поддерживающую терапию. Чтобы уменьшить риск тромбоцитоза во время поддерживающей терапии,17 дозу постепенно снижали до 300 ед./кг через день, когда количество тромбоцитов превышало 50 х 109/л, и прекращали лечение, когда количество тромбоцитов превышало 100 х 109/л. После родов дозировку в дальнейшем снижали до 300 ед./кг еженедельно и корректировали ее, если количество тромбоцитов не могли поддерживать на уровне выше 30 х 109/л. Если количество тромбоцитов не превышало 30 х 109/л в течение 2 недель или уменьшилось ниже 30 х 109/л и не достигало уровня 30 х 109/л в течение 2 недель после корректировки дозы, лечение прекращалось (рисунок 1). Если пациенты испытывали сильные симптомы кровотечения, разрешалось переливание тромбоцитов. Любая потребность в дополнительных специальных процедурах для лечения ИТП считались терапевтической неудачей.
Таблица 1. Базовые характеристики пациентов, включенных в исследование (n=31)
| Характеристики | Все пациенты (n=31) |
| Возраст, средний (МКИ), лет | 26 (24-33) |
| Внутриутробный возраст плода, средний (МКИ), недель | 24 (16-27) |
| 13-17 нед. n(%) | 11 (35,5) |
| 18-22 нед. n(%) | 5 (16,1) |
| 23-27 нед. n(%) | 8 (25,8) |
| 28-32 нед. n(%) | 4 (12,9) |
| ³33 нед. n(%) | 3 (9,7) |
| Количество тромбоцитов при включении в исследование, сред (МКИ), 109/л | 10 (6-12) |
| Первородящая, n(%) | 29 (93,5) |
| Сопутствующие заболевания, n(%) | |
| повышенное кровяное давление | 3, (9,7) |
| диабет | 4 (12,9) |
| Выявление ИТП, n(%) | |
| До беременности | 23 (74,2) |
| Во время беременности | 8 (25,8) |
| Предшествующая терапия, n(%) | |
| Дексаметазон+переливание тромбоцитов | 7 (22,6) |
| Преднизон+переливание тромбоцитов | 8 (25,8) |
| ВВИГ+переливание тромбоцитов | 9 (29,0) |
| Дексаметазон+ВВИГ+переливание тромбоцитов | 2 (6,5) |
| Преднизон+ВВИГ +переливание тромбоцитов | 4 (12,9) |
| Дексаметазон+Преднизон+ВВИГ+переливание тромбоцитов | 1 (3,2) |
| Максимальное количество тромбоцитов при предшествующей терапии, n(%) | |
| <30 х 109/л | 31 (100) |
| ³30 х 109/л | 0(0) |
| Общее количество перелитых тромбоцитов на пациента (ед.)*, сред. (МКИ) | 10 (6-17) |
| Рефрактерность к переливанию тромбоцитов, n(%) | 31 (100) |
| Пациенты со стабильной дозировкой (15-30мг/сутки) преднизона до зачисления в исследование, n(%) | 10 (32,3) |
Таблица 2. Шкала оценки кровотечения до и после лечения
| Шкала оценки | Включение, n(%) | 14 день, n(%) |
| 0 | 0 (0) | 25 (80,6) |
| 1 | 19 (61,3) | 4 (12,9) |
| 2 | 10 (32,3) | 2 (6,5) |
| 3 | 2 (6,4) | 0 (0) |
| 4 | 0 (0) | 0 (0) |
Результаты лечения
Первичной конечной точкой было количество тромбоцитов больше 30 х 109/л на 14-й день исследования. Количество тромбоцитов определялось в каждом объединенном центре. Полный положительный ответ на лечение определялся количеством тромбоцитов не менее 100 х 109/л и отсутствием кровотечения. Положительный ответ на лечение определялся количеством тромбоцитов более 30 х 109/л и увеличением их количества, по крайней мере, в два раза больше чем на момент включения в исследование. Количество тромбоцитов ниже 30 х 109/л определяло отсутствие ответа на лечение. Мы рассмотрели следующие вторичные конечные точки: побочные эффекты у матерей и новорожденных; количество тромбоцитов у новорожденных при рождении, на 3-й день и 7-й день, если необходимо (тромбоцитопенические новорожденные), и 42-й день; мертворождение, преждевременные роды (до 37 недель беременности) и вес при рождении < 2,5 кг. Побочные эффекты регистрировались и оценивались в соответствии с общей терминологией критериев нежелательных явлений, версия 4.0. Состояние всех пациентов оценивалось еженедельно для определения эффективности и безопасности лечения во время беременности и с интервалом в 4 недели в течение 24 недель после родов. После рождения педиатры ежемесячно измеряли физические показатели младенца (например, рост, вес, окружность головы, окружность грудной клетки, окружность брюшной полости) и проводили оценку развития (например, общая моторика, мелкая моторика, адаптивная способность, язык и социальное поведение) в соответствии с китайскими стандартами роста детей и шкалой развития Гезелла.18
Оценка кровотечения проводилась на первый и 14-й дни, в соответствии с шкалой оценки указанной рабочей группой ИТП «Gruppo Italiano Malattie Ematologiche dell’Adulto».19 Тяжесть кровотечения оценивалась следующим образом: степень 0, отсутствие кровотечения; степень 1, петехии; степень 2, экхимозы и/или капание с умеренной потерей крови; степень 3, крупные слизистые кровоизлияния с обильной потерей крови без осложнений; и степень 4, крупное слизистое и/или паренхиматозное кровоизлияние с обильной потерей крови с осложнениями и/или угрозой для жизни или смертельным исходом.
В предыдущих исследованиях нейтрализующие антитела, направленные на эндогенный ТП, были обнаружены у пациентов, получавших пегилированный рекомбинантный человеческий мегакариоцитарный фактор роста и развития.13,20,21. Поэтому антитела к сывороточному ТП измеряли с помощью иммуноферментного анализа с ферментной меткой через 4 недели после получения первой дозы, в конце лечения рЧТП и через 6 месяцев после родов.22
Учитывая, что рЧТП может проходить через плаценту, уровни ТП в пуповинной крови были измерены у новорожденных от здоровых женщин и от пациентов с ИТП, получивших лечение рЧТП с использованием комплектов иммуноферментного анализа с ферментной меткой (R & D Systems) в соответствии с инструкциями изготовителя. Также измерялись уровни сывороточной ТП у матерей с ИТП до и после лечения с рЧТП для подтверждения измеримости экзогенного ТП.
Статистический анализ
Все участники, которые получили, по меньшей мере, 1 дозу рЧТП, были включены в основные анализы и анализы безопасности. Исходные характеристики исследуемой группы пациентов были обобщены с использованием дескриптивных статистических методов. Корреляции были проанализированы с использованием корреляции Спирмана. Отличия между группами анализировали с помощью точного критерия Фишера или t-критерия. Значение P менее 0,05 считалось статистически значимым. Управление данными и статистический анализ проводились с использованием Пакета программ обработки статистических данных общественных наук, версия 22.0 (SPSS, Чикаго, Иллинойс).
Это исследование зарегистрировано на сайте www.clinicaltrials.gov как NCT02391272.
Результаты
Пациенты
В период с 20 марта 2015 года и до 17 ноября 2015 года в исследование было включено 32 беременных пациента с ИТП. У 1 пациента диагноз изменился с ИТП на апластическую анемию до начала лечения. Все матери с ИТП проходили обследование до окончания 24-й недели после родов. Средний период наблюдения для младенцев составлял 53 (интервал от 39 до 68) недели. Средний возраст беременных пациентов с ИТП составлял 26 лет (межквартильный интервал [МКИ], 24-33 года), и 93,5% (29/31) из них были первобеременными (таблица 1). Средний внутриутробный возраст плода на момент включения в исследование составлял 24 недели (МКИ, 16-27 недель) (таблица 1). Среднее количество тромбоцитов при включении в исследование составляло 10 х 109/л (МКИ, 6-12 х 109/л) (таблица 1).
У трех пациентов была сопутствующая гипертоническая болезнь, вызванная беременностью, а у 4 – диабет, связанный с беременностью (таблица 1). У семидесяти четырех процентов (23/31) из этих пациентов была диагностирована ИТП до беременности, а у 25,8% (8/31) была диагностирована ИТП во время беременности (таблица 1). Ни у кого из зарегистрированных беременных пациентов с ИТП никогда не регистрировался ответ на предыдущие процедуры лечения. Хотя у некоторых пациентов временно увеличивалось количество тромбоцитов, ни один из их пиковых показателей не превышал 30 х 109/л (таблица 1). Всем пациентам производили множественные переливания, вследствие чего у них развилась рефрактерность к переливанию тромбоцитов до включения в исследование (таблица 1). Среднее общее количество тромбоцитов, переливаемых одному пациенту, составляло 10 единиц (МКИ, 6-17 единиц, таблица 1). Десять пациентов получали стабильную дозу (МКИ, 15-30 мг/сут) преднизона до включения в исследование (таблица 1). В день включения у большинства пациентов были оценены показатели кровотечения для степени 1 с петехиями или степени 2 с гематурией (таблица 2). У двоих пациентов степень кровотечения оценили как 3 с кровотечением десны и влагалища, соответственно (таблица 2).
Клинический ответ
У 74,2% (23/31) из этих пациентов отметили клинический ответ на начальную 14-дневную терапию с рЧТП, в том числе у 10 был полный ответ и у 13 ответная реакция. У восьми пациентов не было ответной реакции, хотя количество их тромбоцитов незначительно увеличилось (рис. 2). Среднее количество тромбоцитов у пациентов, ответивших на лечение, составило 100 х 109/л (МКИ, 36-160 х 109/л) в 14 день. На 14-й день у большинства участников была определена степень 0 (25/31, 80,6%, таблица 2). По-видимому, у 26 пациентов улучшились симптомы кровотечения. Среди 23 респондентов только у 1 все еще отмечались кровоизлияние (петехии). У 4 пациентов, не ответивших на лечение, улучшились показатели кровотечения, хотя количество тромбоцитов у них не соответствовало уровню ответа. Частота ответов на лечение у пациентов со стабильной дозой преднизона и без нее на момент включения составляла 70,0% (7/10) и 76,2% (16/21), а среднее количество тромбоцитов на 14 день составило 84 х 109/л (МКИ, 28-141 х 109/л) и 36 х 109/л (МКИ, 25-127 х 109/л). Между этими двумя группами не было существенной разницы (P>0,999; P=0,264). Кроме того, пиковое количество тромбоцитов во время предыдущего лечения не влияло на то, реагировали ли пациенты на лечение с рЧТП (P=0,492).
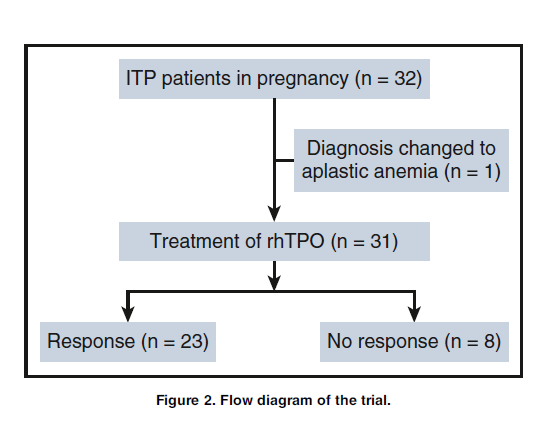
Рис.2 Схема испытания
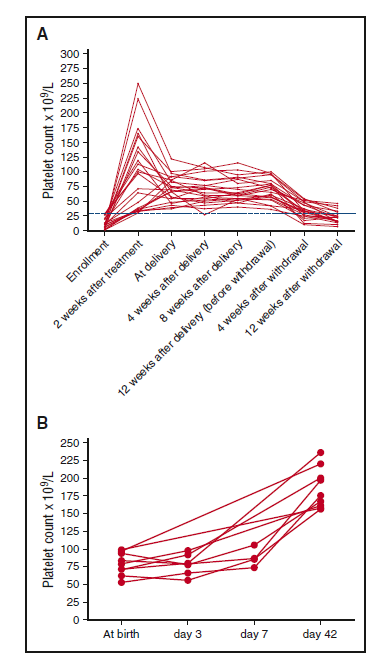
Рисунок 3. Динамическое изменение количества тромбоцитов. (A) Количество тромбоцитов у пациентов, ответивших на лечение (n=23). (B) Количество тромбоцитов у тромбоцитопенических новорожденных (n=9). Точки указывают количество тромбоцитов пациентов. Пунктирная линия указывает количество тромбоцитов 30 х 109/л.
У одного из пациентов, ответивших на лечение, была временная потеря ответной реакции во время лечения после родов. Хотя в это же время был диагностирован грипп, связь между гриппом и уменьшением количества тромбоцитов была неопределенна. После корректировки дозы рЧТП от 300 ед./кг еженедельно до 300 ед./кг через день количество тромбоцитов при следующем обследовании превысило 50 х 109/л.
Количество тромбоцитов постепенно снижается после отмены рЧТП. Уровень безрецидивной выживаемости (количество тромбоцитов не менее 30 х 109/л) на 4 и 12 неделю после отмены рЧТП составил 69,6% (16/23) и 21,7% (5/23) соответственно (рисунок 3A).
Безопасность матерей
Безопасность и побочные эффекты оценивались у всех 31 участника. рЧТП хорошо переносится. Наблюдались только умеренные ранее отмеченные побочные эффекты, в том числе 1 случай головокружения, 1 случай усталости и 1 случая болезнености в месте инъекции (таблица 3).14,23. В течение периода наблюдения не было отмечено никаких новых побочных эффектов, и никаких новых побочных эффектов связанных с прекращением исследований. Об акушерских состояниях не сообщалось. Среди участников не было обнаружено антител к ТП.
Безопасность младенцев
Также осуществили оценку безопасности 31 младенца. Семь беременностей (22,6%, в том числе 4 пациента с ответной реакцией и 3 с отсутствием реакции) разрешились с помощью кесарева сечения, а 24 – вагинальными родами. У всех 31 новорожденного средний внутриутробный возраст плода составил 39 недель (МКИ, 37-40 недель, 3 случая < 37 недель, таблица 4). Средний вес при рождении составил 3,1 кг (МКИ, 2,9-3,5 кг, в 2 случаях вес при рождении был < 2,5 кг, таблица 4). Средний показатель тромбоцитов при рождении составлял 132 х 109/л (МКИ, 97-176 х 109/л). Не было корреляции между количеством тромбоцитов у матерей и новорожденных (P=0,151). Количество тромбоцитов менее 100 х 109/л было обнаружено при рождении у 9 новорожденных (таблица 4). Хотя у некоторых из них и было временное снижение тромбоцитов на 3-й день, ни у одного из них не было кровотечений, а количество тромбоцитов не падало ниже уровня 50 х 109/л. Тромбоцитопения у этих новорожденных возникала спонтанно в течение 42 дней (рис. 3В). У обоих повторнородящих матерей была диагностирована ИТП до первой беременности. Неонатальные показатели тромбоцитов у обоих повторнородящих матерей при первой и теперешней беременности составили 121 х 109/л и 146 х 109/л и 132 х 109/л и 107 х 109/л соответственно.
Средние уровни сывороточного ТП у 31 матери с ИТП до и после лечения рЧТП составили 1434,98 пг/мл (МКИ, 932,06-1932,95 пг/мл) и 4987,23 пг/мл (МКИ, 4198,54-5932,98 пг/мл), что свидетельствует о значительной разнице (P<0,001) (рисунок 4A). Средний уровень ТП пуповинной крови у новорожденных от 15 здоровых женщин и 10 беременных пациенток с ИТП, проходивших лечение с рЧТП, составил 327,30 пг/мл (МКИ, 270,68-416,48 пг/мл) и 364,93 пг/мл (МКИ, 261,37-412,35 пг/мл), соответственно (рисунок 4B). Между двумя группами не было существенной разницы (P=0,789).
Ни врожденного заболевания или задержки в развитии новорожденных не наблюдалось во время последующего наблюдения на протяжении 53 (диапазон, 39-68) недель. Сообщалось об одном случае вздутия живота, который спонтанно решался во время наблюдения (таблица 3).
Обсуждение
Варианты лечения ИТП во время беременности ограничены, если у пациентов отсутствует реакция на ВВИГ и кортикостероиды. Это первое исследование для определения эффективности и безопасности рЧТП в лечении ИТП во время беременности. В нашем исследовании общая частота ответной реакции на рЧТП у беременных пациентов с ИТП была по крайней мере такой же, как у небеременных пациентов с ИТП, если не лучше.14 Стабильная доза преднизона при включении в исследование не влияла на их реакцию на рЧТП. рЧТП повышал уровень тромбоцитов у пациентов с ответной реакцией в течение 2 недель, что значительно уменьшало риск кровоизлияния для пациентов с ИТП во время беременности. Кроме того, похоже, что рЧТП значительно улучшает симптомы кровотечения, даже у пациентов с отсутствием реакции. Пациентов с ИТП во время беременности можно разделить на 2 подгруппы: пациенты с ИТП, диагностированной до беременности, и те, у которых ИТП была диагностирована во время беременности. У первых может проявится обострение или рецидив во время беременности.24,25 Лечение этих двух подгруппами одинаковое. Результаты аналогичные.26 Поэтому в нашем исследовании мы не стратифицируем испытуемых пациентов.
Таблица 3. Зарегистрированные побочные эффекты
| Побочные эффекты | n (%) |
| Пациенты (n=31) | |
| Головокружение | 1 (3,2) |
| Усталость | 1 (3,2) |
| Болезненность в месте инъекции | 1 (3,2) |
| Новорожденные (n=31) | |
| Тромбоцитопения | 9 (29,0) |
| Вздутие живота | 1 (3,2) |
Побочные эффекты регистрировались у всех 31 пациента, которые принимают по меньшей мере 1 дозу рЧТП и у их младенцев.
Таблица 4. Перинатальный исход у беременных женщин с ИТП
| Перинатальный исход | Все новорожденные (n=31) |
| Рождение живого ребенка, n (%) | 31 (100) |
| Мертворождение, n (%) | 0(0) |
| Внутриутробный возраст плода, средн., (МКИ) нед. | 39 (37-40) |
| Преждевременные роды (до 37-ой нед.), n (%) | 3 (9,7) |
| Вес при рождении, сред., (МКИ), кг | 3,1 (2,9-3,5) |
| Вес при рождении <2,5 кг, n (%) | 2 (6,5) |
| Рост новорожденного, сред., (МКИ), см | 50,2 (48,4-51,3) |
| Окружность головы новорожденного, сред., (МКИ), см | 34,3 (33,6-35,2) |
| Окружность грудной клетки новорожденного, сред., (МКИ), см | 33,1 (31,9-34,5) |
| Окружность брюшной полости новорожденного, сред., (МКИ), см | 33,0 (32,0-34,4) |
| Количество тромбоцитов при рождении, n (%) | |
| <50 х 109/л | 0 (0) |
| 50-100 х 109/л | 9 (29,0) |
| Геморрагические осложнения, n (%) | 0 (0) |
| Смерть новорожденного, n (%) | 0 (0) |
рЧТП вел себя как линейный фармакокинетик. При подкожном введении в дозировке 150, 300 и 600 ед./кг здоровым субъектам, период его полуабсорбции (T1/2Ka) может увеличиваться с дозой (2,5-4,2 часа), а время достижения максимальной концентрации составляло 9,0-11,8 часов, что было одинаковым для трех уровней дозировки, указывая на то, что уровень дозировки не влияет на его абсорбцию. Кроме того, значение площади под фармакокинетической кривой было приблизительно пропорциональным введенной дозе, демонстрируя почти что линейную зависимость. В естественных условиях, рЧТП имел длительный период полувыведения и расширенную фазу выведения (38,7-46,3 часа), возможно, из-за большой молекулярной массы и значительного гликозилирования агента.27
В нашем исследовании 69,6% (16/23) и 21,7% (5/23) пациентов не нуждались в лечении на 4 и 12 неделях после отмены рЧТП.
В недавнем ретроспективном исследовании с большим объемом выборки Sun et al сообщили, что эффективность применения кортикостероидов и ВВИГ может быть ниже у беременных, чем у небеременных пациентов с ИТП.12. Лечение беременных пациентов с ИТП остается большой проблемой. Предыдущие отчеты о вторичных методах лечения ограничиваются либо ретроспективным характером, либо небольшим объемом выборки. Спленэктомия может быть выполнена во втором триместре.11 Циклоспорин А используется при других аутоиммунных заболеваниях и не имеет значительной токсичности для матери или плода во время беременности.29,30 Сообщается, что применение азатиоприна является безопасным для беременных с системной красной волчанкой и трансплантация почек31-33, но время ответной реакции может составлять от 3 до 6 месяцев. Эти методы лечения были направлены на снижение разрушения тромбоцитов. Ромиплостим, агонист рецептора тромбопоэтина, был использован в нескольких случаях лечения беременных с ИТП.34,35 Однако недавно опубликованный отчет о болезни показал, что монотерапия ромиплостимом была недостаточной для поддержания стабильного количества тромбоцитов у беременной пациентки с ИТП. Предродовые схватки были вызваны для случая тромбоцитопении на 33 неделе и 6 дней. Новорожденный имел внутрижелудочковое кровоизлияние III степени, которое привело к умеренной задержке моторики и доброкачественной наружной гидроцефалии. У младенца также обнаружена недостаточность надпочечников и фимоз. Связь между этими врожденными заболеваниями и агонистами рецептора ТП до сих пор не ясна34.
рЧТП хорошо переносится беременными пациентами с ИТП. В предыдущих исследованиях наиболее часто сообщаемыми побочными эффектами применения рЧТП были лихорадка, верхняя респираторная инфекция, боль в месте инъекции, головокружение и т. Д.14,23 Данные о безопасности в нашем исследовании соответствовали предыдущим отчетам. В течение периода наблюдения не было обнаружено никаких новых побочных эффектов, и никаких побочных эффектов, связанных с прекращением лечения.
Предыдущие исследования показали, что пациенты, использующие тромбопоэтические агенты, такие как рЧТП, ромиплостим и ельтромбораг, подверглись риску тромбоза.36-38 Однако, частота тромбоза не увеличивалась в дальнейшем еще больше с длительным периодом лечения и, по-видимому, не была связана с числом тромбоцитов.37 Являются ли эти события результатом введения тромбопоэтических агентов или быстрого увеличения количества тромбоцитов неизвестно.39 И в некоторых других исследованиях не было отмечено более высокой частоты тромбоэмболических осложнений.40,41 Большинство тромбоэмболических осложнений наблюдались у пациентов с, по меньшей мере, одним дополнительным фактором риска тромбоза, такими как, сопутствующие патологии, спленэктомия, госпитализация, долгосрочная стероидная терапия или предыдущая история сосудистого заболевания.36,38,39,42 Беременные женщины подвержены тромбозу из-за их состояния гиперкоагуляции. Таким образом, тромбоз является одним из основных вопросов в лечении ИТП при беременности с использованием таких агентов. В нашем исследовании мы приняли индивидуальную корректировку дозы; то есть мы скорректировали дозу рЧТП в соответствии с показателем каждого пациента и поддерживали количество тромбоцитов между 50 и 100 х 109/л, чтобы уменьшить риск тромбоцитоза. Несмотря на отсутствие тромбоэмболических осложнений, его необходимо тщательно контролировать, чтобы избежать такого тромботического осложнения для матерей во время использования рЧТП.
В этом исследовании также были учтены антитела к ТП. Была еще одна рекомбинантная молекула тромбопоэтина, пегилированный рекомбинантный человеческий мегакариоцитарный фактор роста и развития, применение которой было прекращено в 1998 году из-за нейтрализации аутоантител к эндогенной ТП у нескольких пациентов и здоровых пациентов, что привело к стойкой тромбоцитопении.13,20,21
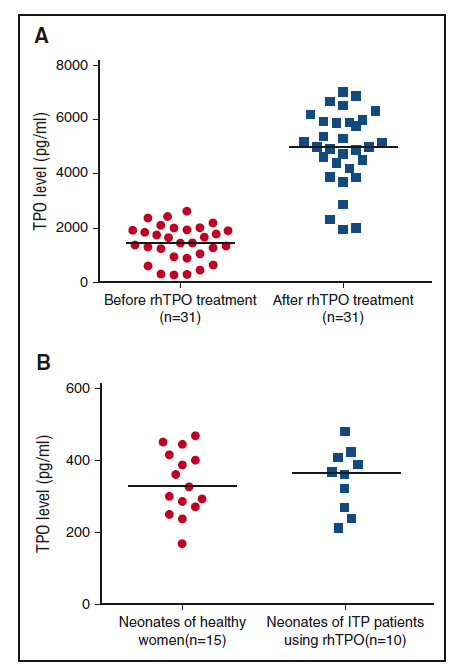
Рисунок 4. Уровень ТП в разных группах. (A) Уровень сывороточного ТП у беременных пациентов с ИТП до и после лечения рЧТП. (B) Уровень ТП пуповинной крови у новорожденных здоровых женщин и пациентов с ИТП с применением рЧТП. Горизонтальная линия указывает средний уровень ТП.
В отличие от пегилированного рекомбинантного человеческого мегакариоцитарного фактора роста и развития (усеченный и негликозилированный ТП), рЧТП представляет собой полноразмерный и гликозилированный ТП, синтезированный клетками яичника китайского хомяка, который почти идентичен эндогенному ТП. Предыдущие исследования показали, что от 1 до 3% пациентов с ИТП были обнаружены развивающиеся транзиторные, низкотитровые и не нейтрализованные антитела к ТП после мультидозирования, подкожной инъекции.23,43
В нашем исследовании не было обнаружено антител к ТП, хотя ограниченный объем выборки исключает окончательный вывод.
В нашем исследовании частота преждевременных родов, вес при рождении и количество тромбоцитов новорожденных соответствовали предыдущим отчетам о результатах исхода беременности у пациентов с ИТП.12,26,44
Связанная с беременностью аутоиммунная неонатальная тромбоцитопения представляет собой заболевание, проходящее без лечения, с максимальным снижением уровня тромбоцитов в постнатальные 4 и 5 дни, после чего большинстве случаев количество тромбоцитов повышается до нормального уровня в течение 1 месяца25. В нашем исследовании неонатальная тромбоцитопения отмечалась у 9 новорожденных. Учитывая, что во всех случаях она проходила бессимптомно с числом тромбоцитов выше 50 х 109/л, мы не проводили лечения. Во всех случаях количество спонтанно восстанавливалось при повторном измерении на 42-й день. Неонатальные показатели тромбоцитов в 2 случаях повторной беременности на этот раз были сопоставимы с показателями при первой беременности.
Внутримозговое кровоизлияние является серьезным осложнением для новорожденных. Однако методы предотвращения и лечения внутримозгового кровоизлияния остаются спорными. Подтверждение раннего выявления внутримозгового кровоизлияния у новорожденных с помощью ультразвука ограничены.45 Williams et al рекомендовали рассмотреть возможность применения сканирования и профилактики после травматических родов.46 Также рекомендуется выполнять ультразвуковое исследование головки плода, когда количество тромбоцитов меньше 50 х 109/л. К счастью, в нашем исследовании такого случая не было; поэтому ультразвуковые исследования не проводились. Поскольку все новорожденные в нашем исследовании были бессимптомными с максимальным количеством снижения тромбоцитов выше 50 х 109/л, мы пришли к выводу, что ни у одного из детей не было внутримозгового кровоизлияния.
Еще одна проблема, которая препятствует использованию новых миметиков тромбопоэтина в лечении беременных с ИТП, заключается в том, что они могут проникать через плаценту и влиять на плод. рЧТП имеет молекулярную массу 90 000 дальтон и имеет теоретическое преимущество по сравнению с распространенным в настоящее время непептидным ТП-миметиком, элтромбопаг, который имеет молекулярную массу меньше 1000 дальтон. Хотя существует несколько механизмов, которые могут влиять на прохождение плаценты, порог для плацентарного прохода считается менее 5000 дальтон. Исключением является продаваемый в настоящее время пептидный миметик, ромиплостим с молекулярной массой 60 000 дальтон. Ромиплостим содержит CH2 и CH3 домены IgG-Fc, которые позволяют связывать Fc-рецепторы.48 Эта структура не только способствует длительному периоду полураспада ромиплостима49, но и способствует его транспортировке через плаценту50-52. У грызунов через 12 дней после введения ромиплостима, препарат был обнаружен как в плодной сыворотке, так и в амниотической жидкости.53 Существует недостаточно данных о том, может ли элтромбопаг проходить через плаценту, хотя некоторые из них заявили о такой возможности.36 По этим причинам, применение элтромбопага и ромиплостима при беременности должна быть более обдуманным. рЧТП с молекулярной массой 90 000 дальтон теоретически не мог пройти через плаценту. Существует ли какой-либо активный механизм транспорта через c-Mpl, остается неизвестным. В нашем исследовании значительная разница уровней сывороточного ТП до и после лечения рЧТП показала измеримость экзогенного ТП. Уровни ТП пуповинной крови у новорожденных от пациентов с ИТП, получавших рЧТП, не отличались от таковых у новорожденных от здоровых беременных женщин, что свидетельствовало о том, что рЧТП не может пройти через плаценту.
Это исследование демонстрирует, что рЧТП является потенциально безопасным, эффективным и быстродействующим лечением беременных пациентов с ИТП, которые невосприимчивы к первоочередной терапии и переливанию тромбоцитов. Наша работа проложила путь для дальнейшего изучения клинического применения рЧТП и других тромбопоэтических агентов в лечении ИТП во время беременности.
Признательность
Авторы выражают благодарность Александре Г. Маршалл (Marshall Medical Communications) за редактирование рукописи.
Эта работа была поддержана грантами Национального фонда естественных наук Китая (№ 81470284, № 81500094), Основным планом исследований Национального фонда естественных наук Китая (№ 91442204), Государственной ключевой клинической специальности Китая по заболеваниям крови, Ключевого клинического исследовательского проекта Министерства здравоохранения Китая 2010-2012 гг., Фонда естественных наук провинции Шаньдун (№ 2016ZRE27681), ученного Тайшань провинции Шаньдун и Фондом по тромбоцитопении от Юхонгской бизнес-школы Шэньянского фармацевтического университета (финансирование ПТС).
Авторство
Вклад: Z.K. проанализировал данные и написал первый черновик рукописи; P.Q. и S.X. координировал исследование, анализировал данные и редактировал рукопись; H.Z. собрал данные и отредактировал рукопись; H.L., R.Y., X.L., J.L., Z.L., G.J., Z.C., Y.B., Y.W. и L.S. обеспечил клинический ввод и собрал данные; J.P., J.M. и M.H. разработал протокол исследования, проанализировал данные и отредактировал рукопись.
Раскрытие конфликта интересов: авторы не заявляют о каких-либо конкурирующих финансовых интересах.
Переписка: Мин Хоу, отделение гематологии, больница Цилу, университет Шаньдун, Цзинань 250012, Китай; и Jun Ma, Харбинский институт гематологии и онкологии, Харбинская первая больница, Харбин, Хэйлунцзян 150010, Китай; и Джун Пэн, отдел гематологии, больница Цилу, университет Шаньдун, Цзинань 250012, Китай.
* Продукт аферезных тромбоцитов: 2,5 х 1011/ед.
