Рекомбинантный человеческий тромбопоэтин улучшает восстановление тромбоцитов после аллогенной трансплантации гемопоэтических стволовых клеток: рандомизированное контролируемое клиническое исследование.
Резюме
Цель исследования: оценить эффективность и безопасность применения рекомбинант-ного человеческого тромбопоэтина (рЧТП) у пациентов, получающих аллогенную трансплантацию гемопоэтических стволовых клеток (алло-ТГСК).
Методы: 123 пациента, которые получали алло-ТГСК после стандартных схем миелоаблатив-ных режимов кондиционирования (МАК), были рандомизированы на группы с целью назначе-ния рЧТП (n=61) в дозе 1,0 г/кг×д1 подкожно на 7–20-й день или при снижении числа тромбо-цитов ≥100×109/л до 20-го дня, и контрольную группу (n=62).
Результаты: скорость регенерации тромбоцитов была выше при назначении рЧТП по сравнению с контрольной группой (р=0,008) через 3–8 недель мониторинга количества тромбоци-тов при их уровне ≥100×109/л. Скорость восстановления тромбоцитов оказалась выше в груп-пе, которой назначался рЧТП, чем в контрольной группе – 28 дней (15–379) против 33 дней (19–148) (р=0,008). Медиана времени восстановления тромбоцитов в группе, получавшей рЧТП, также оказалась значительно выше, чем в контрольной группе: 28 дней (15–379) против 33 дней (19–148) (р=0,008). Следует отметить, что время восстановления тромбоцитов при уровне тромбоцитов ≥20×109/л составило 28 дней (15–379) против 33 дней (19–148), р=0,008; при количестве тромбоцитов ≥50×109/л 28 дней (15–379) против 33 дней (19–148), р=0,008. Существенных различий выявлено не было. При критическом ограничении переливания тромбоцитарной массы среднее число единиц тромбоцитов, перелитых в течение 100 дней после трансплантации, было снижено с 8 единиц (0–52 единицы) в контрольной группе до 5 единиц (1–39 единиц) в группе, получавшей рЧТП (p=0,003). Количество трансплантированных СD34+-клеток коррелировало с восстановлением тромбоцитов в обеих группах. После среднего периода наблюдения в течение 12,5 (0,7–46,5) месяца частота возникновения побочных эффектов, восстановления гранулоцитов, острой или хронической реакции «трансплантат против хозяина», веноокклюзионной болезни печени и гепаторенальной дисфункции была одинаковой в обеих группах. Также существенных различий не наблюдалось по частоте смертности после трансплантации, рецидивов, общей выживаемости и безрецидивной выживаемости в обеих группах за период последующего наблюдения.
Выводы: рЧТП хорошо переносится, улучшает восстановление тромбоцитов после алло-ТГСК и способствует уменьшению количества перелитых единиц тромбоцитов.
Ключевые слова: рекомбинантный человеческий тромбопоэтин (рЧТП), трансплантация гемопоэтических стволовых клеток (ТГСК), ответ на терапию, побочные эффекты.
Abstract
Objective to evaluate the efficacy and safety of recombinant humanized thrombopietin (rhTPO) treatment in patients receiving allo-HSCT. Methods 123 patients receiving allo-HSCT after standard myeloablative conditioning regimens were randomized to receive rhTPO (n = 61) at 1.0 g / kg •d-1 subcutaneously on d 7~20 or when the platelet counts were ≥100 × 109 / L before day 20 or the control group (n=62). Results The rate of platelet recovery was higher with rhTPO than that with the control group (P=0.008) after 3~8 weeks platelet counts monitoring, when the platelet counts were ≥100 × 109 / L, rate of platelet recovery was higher with rhTPO than that with the control group 28 d (15~379) vs 33 d (19~148) (P=0.008) either. The median time of platelet recovery in the rhTPO group was significantly more rapid than that in the control group 28 d (15~379) vs 33 d (19~148), P=0.008). But the time of platelet recovery when the platelet counts were ≥20 × 109 / L 28 d (15~379) vs 33 d (19–148), P=0.008. or ≥50 × 109 / L 28 d (15~379) vs 33 d (19~148), P=0.008 were not significant differerce. Under the critically restricted transfusion support. The median number of unites platelets transfused within the 100 d after transplantation was decreased from 8 units (0~52 units) in the control group to 5 units (1~39 units) in the rhTPO group (P=0.003). The number of transplanted CD 34 + cells was correlated with platelet recovery in both groups. After a median follow-up of 12.5 (0.7~46.5) months, the occurrence rate of adverse events, granulocyte recovery, acute and chronic graft versus host disease, and hepatic veno-occlusive disease and hepatorenal dysfunction was similar between the two groups. No significant difference was observed between the two groups in transplantation related death, relapsed, and overall survival and relapse free survival during the follow-up. Conclusion rhTPO were well tolerated and could improve platelet recovery post-allo-HSCT and reduce the number of unites platelets transfusion needed.
Keywords: recombinant humanized thrombopietin (rhTPO), hematopoietic stem cell transplantation (HSCT), response, adverse events.
Миелоаблативное кондиционирование костного мозга при аллогенной трансплантации гемопоэтических стволовых клеток (алло-ТГСК) практически всегда приводит к продолжительной выраженной тромбоцитопении и увеличивает риск развития смертельных кровотечений у пациентов после трансплантации. К основным методам лечения и профилактики следует отнести курс интенсивной терапии и переливание тромбоцитарной массы. Следует отметить, что повторное переливание тромбоцитарной массы может приводить к большому числу негативных эффектов, включая трансфузионные реакции, изоиммунизацию тромбоцитов и инфицирование вирусными агентами при переливании компонентов крови, а также к увеличению расходов на медицинские услуги [1]. Цитокиновые тромбоцитарные факторы роста, возможно, смогут изменить текущую ситуацию.
Несмотря на то, что FDA (США) одобрило использование интерлей-кина-11 (ИЛ-11) для коррекции тромбоцитопении, ассоциированной с химиотерапией, выраженные побочные реакции на сегодня ограничивают его применение [2]. Тромбопоэтин (ТП) является основным цито-кином-регулятором тромбопоэза, который экспрессирует свой специфический рецептор C-MPL исключительно на мегакариоцитах и клетках предшественниках эритроцитов [3, 4]. В нескольких клинических исследованиях был показан положительный эффект рекомбинантного человеческого ТП (рчТП) и пегилированного ТП (ПЕГ-чТП) при проведе-нии химиотерапии опухолей. Но в небольших клинических исследова-ниях, посвященных проблеме развития хронической тромбоцитопении после проведения как алло-ТГСК и ауто-ТГСК совместно, так и ауто-ТГСК отдельно, явный эффект от применения рчТП или ПЕГ-чТП показан не был [5, 6]. Таким образом, необходимы дальнейшие клинические исследования для проведения системной оценки эффективности и безопасности препаратов ТП при алло-ТГСК. Дальнейшие клинические исследования ПЕГ-чТП были прекращены FDA в связи с возможностью образования нейтрализующих антител к ТП.
В то же время в 2006 г. FDA одобрило использование рчТП для коррекции тромбоцитопении, ассоциированной с химиотерапией, а недавно – применение рчТП в терапии рефрактерной иммунной тромбоцитопенической пурпуры. С целью выявить эффективность применения рчТП при алло-ТГСК нами было разработано следующее рандомизиро-ванное контролируемое клиническое исследование.
1. ОБЪЕКТ ИССЛЕДОВАНИЯ И МЕТОДЫ
1.1. Критерии включения и исключения из исследования. Критерии включения: возраст пациентов 12–58 лет, мужчины и женщины; пациенты с онкогематологической патологией, в индивидуальном порядке включались пациенты с врожденными иммунодефицитами, которым требовалось проведение алло-ТГСК; наличие родственных доноров или подходящих неродственных доноров, совместимых по системе HLA, согласных выступить донором костного мозга (КМ) или периферических гемопоэтических стволовых клеток крови (ПГСКК); ограничений по статусу болезни до трансплантации не было, тем не менее, количество баллов по шкале ECOG должно было быть ≤1; подписанное информированное согласие на проведение лечения с использованием препаратов рчТПО после трансплантации.
Критерии исключения: планируемое использование немиелоаблативных режимов кондиционирования или режимов снижения дозы; активные или не полностью контролируемые инфекции или кровотечения; нарушение функции печени или почек: активность аминотрансфераз ≥80 ЕД/л или уровень общего билирубина ≥30 мкмоль/л, креатинин сыворотки ≥133 мкмоль/л. В случае возникновения каких-либо из ниже перечисленных обстоятельств субъектам разрешалось выйти из исследования или прекратить его: желание пациента выйти из исследования; в случае, если исследователь считает, что продолжение исследования может отрицательно повлиять на пациента или процедуру трансплантации.Дизайн исследования. Проводимое нами исследование было одноцентровым, открытым, рандомизированным. Всего в исследование было включено 120 пациентов, которые были распределены в основную и контрольную группы в соотношении 1:1. Пациенты основной группы получали рчТП в дозировке 1,0 мкг/кг×д-1 подкожно на 7–20-й день после трансплантации (14 доз). Если количество тромбоцитов было ниже 100×109/л на 20-й день, введение рчТП прекращалось. Пациенты контрольной группы рчТП не получали.
Основными конечными точками исследования были выявления различий тенденции восстановления количества тромбоцитов в обеих группах, длительность и скорость их восстановления в ключевые точки – ≥20×109/л, 50×109/л и 100×109/л, а также количество единиц тромбоцитов, которые потребовалось перелить в обеих группах. Вторичной конечной точкой было сравнение показателей общей выживаемости, без-рецидивной выживаемости, смерти, ассоциированной с трансплантацией, частоты рецидивов гематологических злокачественных опухолей, осложнений при трансплантации и причин смерти в группах исследования. Исследование проводилось с мая 2006 г. по декабрь 2009 г. (с момента трансплантации плюс собственно исследование), период последующего наблюдения и контрольных визитов закончен 31 марта 2010 г.Поддерживающая терапия после трансплантации и терапия, ассоциированная с трансплантацией. При уровне тромбоцитов20×109/л или 21–60×109/л при активном кровотечении пациентам проводили тромбоцитоферез, количество тромбоцитов, содержащихся в одной единице афереза, составляло >2,5×1011. Пациенты обеих групп получали гранулоцитарный колониестимулирующий фактор (гКСФ) в дозе 5 мкг/кг х д-1 подкожно в 1-й день, пока уровень гранулоцитов не превышал 1,0×109/л. Показатели, которые контролировались во время исследования. При проведении исследования мы отмечали развитие побочных эффектов и связанных с трансплантацией осложнений. Оценка степени тяжести побочных эффектов терапии проводилась в соответствии со стандартом NCI (CTCAE, версия 3.0). Количество единиц тромбоцитов рассчитывалось исходя из их суммарного количества для каждого пациента. Контроль общего анализа крови проводился в течение 180 дней, функции печени и почек в течение 60 дней, определение наличия антител к рчТП – у части пациентов основной группы.Статистический анализ. Тенденция изменений средних значений таких показателей, как количество тромбоцитов, активность трансаминаз, уровень общего и прямого билирубина, креатинина и азота мочевины, оценивалась с помощью дисперсионного анализа. Метод Каплана – Мейера был использован для оценки восстановления количества тромбоцитов, суммарной ожидаемой частоты выживаемости, суммарной частоты рецидивов злокачественных онкогематологических заболеваний, частоты смертности, ассоциированной с трансплантацией, частоты развития реакции «трансплантат против хозяина». Непараметрические критерии были использованы для анализа количества перелитых единиц тромбоцитов. Все статистические измерения проведены с помощью пакета программ SPSS, версия 13.0. При значении р≤0,05 разница показателей считалась достоверной.
2. РЕЗУЛЬТАТЫ
Общие данные. Всего в исследование включено 123 пациента, основная группа включала 61 пациента, контрольная группа – 62 пациентов. Все общие данные о пациентах представлены в табл. 1, статистически значимой разницы между двумя группами не было (р>0,05).Практическое применение рчТП в основной группе. Доза рчТП в основной группе составила 0,88±0,13 мкг/кг х д-1. 50 пациентам (82,0%) рчТП был назначен с 7-го дня. 8 пациентам (13,1%) и в 3 случаях (4,9%) рчТП был назначен на 6-й и 8–9-й день соответственно из-за ошибок, допущенных врачами. 43 пациента (70,5%) завершили курс терапии рЧТП, состоящий из 14 доз препарата, при этом у 5 пациентов (8,2%) количество тромбоцитов было ≥100×109/л до назначения 14-й дозы.
В общей сложности 48 пациентов (78,7%) получили терапию в соответствии с дизайном исследования, отклонение от протокола было зафиксировано в 2 (3,3%) и 10 случаях (16,4%), когда пациенты получили 13 и 15–16 доз рчТП соответственно. Один пациент (1,6%) после приема 7-й дозы рчТП покинул исследование из-за психологических причин, но этот случай не исключался из статистического анализа из-за отсутствия существенного влияния на результат.Восстановление количества тромбоцитов после трансплантации. В табл. 1 показана динамика изменений средних значений тромбоцитов после трансплантации. Полученные результаты свидетельствуют, что восстановление количества тромбоцитов в основной группе, которой назначался рчТП, проходило значительно быстрее, чем в контрольной группе. Различие между 2 группами было статистически достоверным (р=0,008). Количество тромбоцитов восстановилось до максимального значения через 6 недель после трансплантации с 130×109/л в основной группе и 100×109/л в контрольной; минимальное значение количества тромбоцитов в основной группе не увеличивалось. В ключевых точках восстановления количества тромбоцитов ≥20×109/л и ≥50×109/л в обеих группах коэффициенты их аккумулятивного восстановления не показали статистически значимой разницы (р=0,758 и 0,133 соответственно). Среднее время восстановления после трансплантации в двух ключевых точках составило 17,5 (9–95) и 24 (12–197) дня соответственно в основной группе и 19 (11–62) и 26 (14–140) дней соответственно в контрольной группе. Статистически значимой разницы не было выявлено: р=0,505 и 0,076 соответственно, но на ключевой точке ≥100×109/л основная группа показала более высокий результат по частоте и скорости восстановления по сравнению с контрольной (р=0,010) (рис. 2). Медиана времени восстановления, при которой количество тромбоцитов ≥100×109/л, составила 28 (15–379) дней в основной группе и 33 (19–148) дня в контрольной, получена достоверная разница (р=0,008). Среднее время восстановления в основной группе сократилось на 5 дней по сравнению с контрольной группой.Восстановление тромбоцитов коррелировало с количеством пересаженных CD34+-клеток. В среднем пациенты основной группы получали рчТП в дозе 0,86 мкг/кг х д-1, и не было выявлено значимого эффекта на восстановление тромбоцитов от применения его в более высоких или низких дозах (р=0,623). Также на восстановление тромбоцитов значительно не влияло состояние злокачественной опухоли до трансплантации (р=0,601).
Таблица 1. Общие данные пациентов, включенных в исследование
| Основная группа | Контрольная группа | Значение р | ||||||
| 61 | 62 | |||||||
| Возраст реципиента (годы) (диапазон) | 32 | (12–56) | 32 | (12–57) | 0,647 | |||
| Пол (n) | Мужчины | 35 | (57,4) | 40 | (64,5) | 0,368 | ||
| Женщины | 26 | (42,6) | 22 | (35,5) | ||||
| Возраст донора (годы) (диапазон) | 33 | (9–64) | 30 | (14–59) | 0,786 | |||
| Гендерное различие между донором и реципиентом, n (%) | 25 | (41,0) | 30 | (49,4) | 0,261 | |||
| Источник донора | 39 | (63,9) | 37 | (59,7) | 0,627 | |||
| родственный, n(%) | ||||||||
| неродственный, n(%) | 22 | (36,1) | 25 | (40,3) | ||||
| Диагноз | ОМЛ, n (%) | 27 | (44,3) | 17 | (27,4) | 0,350 | ||
| ОЛЛ n (%) | 11 | (18,0) | 16 | (25,8) | ||||
| ХМЛ n (%) | 11 | (18,0) | 21 | (33,9) | ||||
| МДС, n (%) | 7 | (11,5) | 5 (8,1) | |||||
| НХЛ, n (%) | 4 | (6,6) | 2 (3,2) | |||||
| MM, n (%) | 1 | (1,6) | 0 (0,0) | |||||
| Болезнь Брутона, n (%) | 0 | (0,0) | 1 (1,6) | |||||
| Стадия опухоли | 14 | (23,0) | 11 | (17,7) | 0,441 | |||
| Высокий риск, n (%) | ||||||||
| Средний риск, n (%) | 6 | (9,8) | 13 | (21,0) | ||||
| Стандартный риск / доброкачественная, n (%) | 41 | (67,2) | 38 | (61,3) | ||||
| Кондиционирование | 54 | (88,5) | 58 | (93,5) | 0,306 | |||
| ЦФ/ООТ, n (%) | ||||||||
| БУ, n (%) | 6 | (9,8) | 4 (6,5) | |||||
| другие, n (%) | 1 | (1,6) | 0 (0,0) | |||||
| Графт | СКПК n (%) | 57 | (93.4) | 59 | (95,2) | 0,261 | ||
| КМ, n (%) | 4 | (6.6) | 3 (4,8) | |||||
| Количество трансплантированных клеток | ||||||||
| МНК ПК (x108/кг) | 7,92 (3,67–12,85) | 7,47 (2,51–17,96) | 0,960 | |||||
| СД34+ ПК (x106/кг) | 3,89 (1,73–9,24) | 4,00 (0,66–9,44) | 0,842 | |||||
| ЯК КМ (x108/кг) | 3,52 (2,90–8,09) | 3,15 (2,79–4,82) | 0,571 | |||||
Примечания:
ОМЛ – острый миелоидный лейкоз; ОЛЛ – острый лимфобластный лейкоз; ХМЛ – хронический миелоидный лейкоз; МДС – миелодиспластический синдром; НХЛ – неходжкинская лимфома; ММ – множественная миелома; ЦФ – циклофосфамид; ООТ – общее облучение тела; БУ – бусульфан; ПК – периферическая кровь;
МНК – мононуклеарные клетки; ЯК – ядросодержащие клетки.
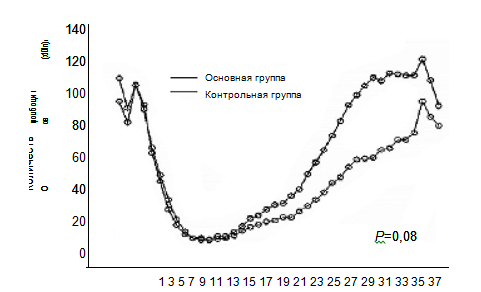
Рис. 1. Динамика изменения средних показателей количества тромбоцитов после трансплантации
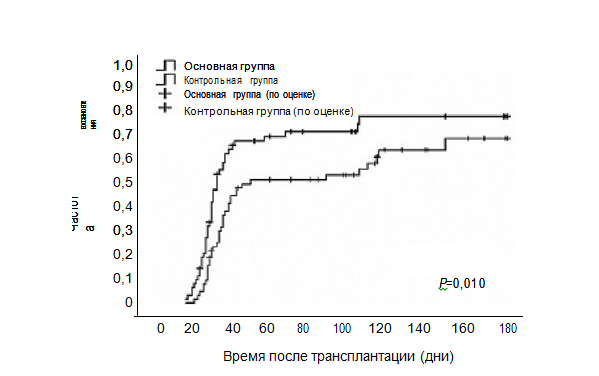
Рис. 2. Частота восстановления тромбоцитов до >100х109/л по оценке с использованием метода Каплана – Мейера
Однако количество пересаженных CD34+-клеток оказало значительное влияние в обеих группах (табл. 3). Когда количество CD34+-клеток составляло ≥4,0×106/кг, восстановление тромбоцитов как в основной, так и контрольной группе происходило быстрее и с более высокой амплитудой по сравнению с таковым в со-ответствующей группе с меньшим количеством CD34+-клеток. Разница была статистически значимой (р=0,018 и р=0,005 соответственно). При сравнении восстановления тромбоцитов пациентов основной группы, получивших трансплантацию CD34+-клеток в количестве <4,0×106/кг, и контрольной группы, получивших ≥4×106/кг, установлено, что динамические изменения в восстановлении тромбоцитов в двух группах не имели существенной разницы (р=0,558), а кривая изменений была практически перекрыта.
Влияние на процесс трансплантации и результаты трансплантации. Суммарная частота приживления нейтрофильных гранулоцитов (≥0,5×109/л) в обеих группах не имела статистически значимой разницы (р=0,123), а среднее время восстановления составляло 15 (от 11 до 21) дней после трансплантации в основной группе и 16 (от 10 до 23) дней в контрольной группе (р=0,026)
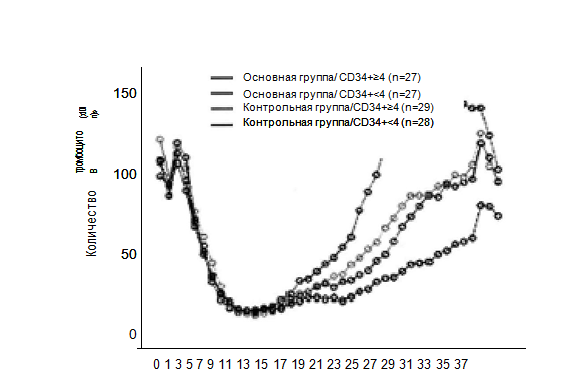
Рис. 3. Влияние количества пересаженных CD34+-клеток на динамические изменения средних значений тромбоцитов в обеих группах
Потребность в переливании тромбоцитарной взвеси. На рис. 4 показана потребность в переливании тромбоцитарной взвеси в течение 100 дней. Медиана потребности в тромбоцитарной взвеси в основной группе составила 5 (1–39) ед. и 8 (0–52) ед. в контрольной группе, что значительно выше, чем в основной группе (р=0,003). Общая потребность в тромбоцитарной взвеси в основной группе составила 450 ед., что на 32% меньше, чем в контрольной группе (662 ед.). Для пациентов с количеством пересаженных CD34+-клеток ≥4,0×106/кг медиана потребности в тромбоцитарной взвеси составила 4 (от 1 до 20) ед., по сравнению с 6 (от 1 до 39) ед. (р=0,083) среди пациентов с количеством клеток <4,0×106/кг в основной группе. Медианы в соответствующих подруппах контрольной группы составили 6 (от 1 до 37) ед. (р=0,048) и 10 (от 0 до 52) ед. (р=0,0001), отмечалась статистически значимая тенденция и разница. Между пациентами подгруппы с меньшим количеством пересаженных клеток основной группы и подгруппы с бóльшим количеством пересаженных клеток контрольной группы не было отмечено достоверной разницы (р=0,891), но в обеих подгруппах отмечалось снижение медианы потребности в переливании тромбоцитарной взвеси, по сравнению в целом с пациентами, получавшими меньшее количество пересаженных клеток (р=0,034 и р=0,004 соответственно).
Суммарная частота основных осложнений трансплантации, таких как острая реакция «трансплантат против хозяина» II–IV степени или III–IV степени, хроническая реакция «трансплантат против хозяина», а также ее генерализованный тип – в обеих группах существенно не отличалась. В основной группе она составила 39,5±6,3%, 16,5±4,8%, 68,2±7,4% и 55,3±9,5% соответственно, а в контрольной группе – 49,1±6,4% (р=0,261), 13,4±4,4% (р=0,880), 65,1±8,1% (р=0,965) и 47,7±9,6% (р=0,402) соответственно.
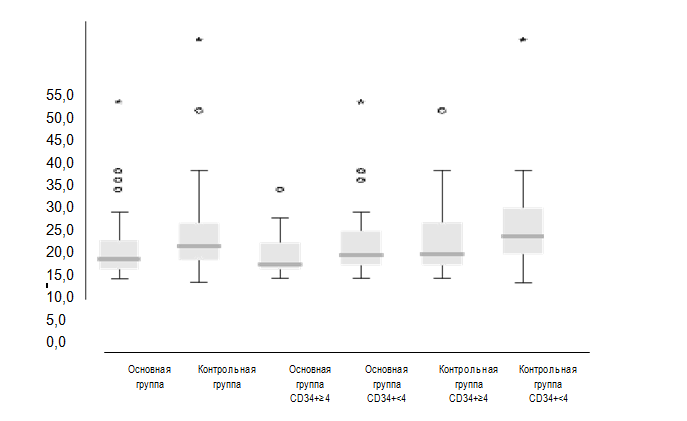
Рис. 4. Блочная диаграмма количества единиц переливания тромбоцитов
Динамические изменения средних значений показателей функции печени и почек, таких как аланинаминотрансфераза (р=0,826), общий билирубин (р=0,656), прямой билирубин (р=0,391), креатинин (р=0,559) и азот мочевины (р=0,342), в течение 10 недель после трансплантации существенно не отличались.
Случаев поражения печени, при которых основным симптомом было увеличение уровня прямого билирубина в течение 60 дней, в основной и контрольной группе (р>0,10) было 11 (18,0%) и 17 (27,4%) соответственно. Основными причинами были поражения печени при развитии острой реакции «трансплантат против хозяина», веноокклюзионная болезнь печени и лекарственное поражение печени. Случаев почечной недостаточности было 9 (14,8%) и 5 (8,1%) среди пациентов в основной и контрольной группе соответственно (p>0,10), а основными причинами были лекарственное поражение почек, инфекции, веноокклюзионная болезнь печени и полиорганная недостаточность. Тяжелые повреждения печени и почек приводили к смерти пациентов: в 3 (4,9%) и 4 случаях (6,6%) соответственно в основной группе и в 2 случаях (3,2%) соответственно в контрольной группе. Осложнениями, связанными с ранним тромбозом после трансплантации, были 5 случаев в основной группе (8,2%), включая 3 случая веноокклюзионной болезни печени (4,9%), 1 случай тромбоэмболии легочной артерии (1,6%) и 1 случай тромботической микроангиопатии (1,6%). У 3 пациентов был тромбоз полой вены в анамнезе. В контрольной группе тромботические осложнения наблюдались в 6 случаях (9,7%) (p>0,10), в том числе 5 случаев веноокклюзионной болезни печени (8,1%) и 1 случай эмболии ствола мозга. Среди них ни у одного пациента не было тромбозов в анамнезе. Данные осложнения, связанные с тромбозом, привели к смерти 3 (4,9%) и 2 (3,2%) пациентов основной и контрольной группы соответственно.
Результаты дальнейшего наблюдения, приведенные в табл. 2, показали важные результаты трансплантации, такие как выживаемость, смертность, смертность, связанная с трансплантацией, рецидив злокачественной опухоли и т.д. Результаты в обеих группах были очень похожи. Основными причинами смерти были рецидивы, реакции «трансплантат против хозяина» и инфекционные осложнения. Их частота 14 случаев (23,1%), 3 случая (4,9%) и 2 случая (3,3%) в основной группе; 13 случаев (21,3%), 4 случая (6,4%) и 3 случая (4,8%) в контрольной группе (разница между двумя группами статистически недостоверная). Другие причины смерти включали веноокклюзионную болезнь печени (1 случай), легочное кровотечение (1 случай) и синдром идиопатической пневмонии (1 случай) в основной группе, эмболию ствола головного мозга (1 случай) и гепатит B (1 случай) в контрольной группе.
Безопасность. Было зарегистрировано 179 случаев симптоматических побочных эффектов у пациентов основной группы и 204 случая в контрольной группе. Неблагоприятные эффекты, связанные с рчТП, в основной группе включали 9 случаев (14,8%): 5 случаев слабости (8,2%), 2 случая мышечной ригидности (3,3%), 1 случай люмбаго (1,6%) и 1 случай боли в костях (1,6%). Все перечисленные реакции были легкой степени и разрешались самостоятельно через 1–2 дня.
Анализ на наличие антител к рчТП. При использовании метода непрямого ИФА для выявления антител к рчТП в сыворотке 17 пациентов основной группы в среднем на 4-й неделе исследования (3–12-й неделе) антител к рчТП не было обнаружено ни у одного пациента.
Таблица 2 Результаты наблюдения после трансплантации
| Основная группа | Контрольная группа | р | ||
| Медиана времени наблюдения (мес.) (диапазон) | 12,5 (0,7–46,5) | 15,8 (1,0–46,0) | 0,094 | |
| Выживаемость, абс. к. (%) | 39 (63,9) | 39 (62,9) | ||
| Суммарная частота 3-летней выживаемости (%) | 51,6±8,7 | 58,9±6,9 | 0,736 | |
| Безрецидивная выживаемость, абс. к. (%) | 37 (60,7) | 37 (60,7) | ||
| Суммарная безрецидивная выживаемость (%) | 53,8±7,9 | 58,2±6,7 | 0,783 | |
| Смерть, абс. к. (%) | 22 (36,1) | 23 (37,1) | ||
| Смерть, связанная с трансплантацией, абс. к. (%) | 8 (13,1) | 10 (16,1) | ||
| Ранняя стадия, абс. к. (%) | 7 (11,5) | 6 (9,7) | ||
| Поздняя стадия, абс. к. (%) | 1 (1,6) | 4 (6,4) | ||
| Суммарная смертность, связанная с трансплантацией (%) | 14,3±4,8 | 16,6±4,8 | 0,691 | |
| Рецидив злокачественной опухоли, абс. к. (%) | 17 (27,9) | 17 (27,9) | ||
| Суммарная частота рецидивов (%) | 38,7±8,4 | 34,3±7,0 | 0,755 | |
| Смерть по причине рецидива, абс. к. (%) | 14 (23,0) | 13 (21,3) |
3. ОБСУЖДЕНИЕ
Среди известных цитокинов рчТП и ПЕГ-чТП являются относительно специфическими цитокинами, связывающимися с рецепторами C-MPL и регулирующими рост мегакариоцитов и тромбопоэз [7]. Результаты клинических исследований рчТП и ПЕГ-чТП при химиотерапии солидных опухолей и лейкозов с ауто-ТГСК дают основания для их клинического исследования при алло-ТГСК.
Во всех клинических исследованиях рчТП и ПЕГ-чТП хорошо переносятся практически без значительных побочных эффектов [8], но с единичными тромботическими осложнениями [9–11]. В данном исследовании у 5 и 6 пациентов наблюдались заболевания, связанные с тромбозом на ранней стадии трансплантации, в основной и контрольной группе соответственно, среди которых в каждой группе у 1 пациента возникла тромбоэмболия легочной артерии. У 60% пациентов основной группы, у которых развились тромботические осложнения, был анамнез тромбоза полой вены, что указывает на то, что рчТП после трансплантации пациентам с гиперкоагуляцией в анамнезе следует назначать с осторожностью. Пациенты контрольной группы также хорошо переносили рчТП, и не было значительной разницы в процессе трансплантации и результатах трансплантации, наблюдаемых между двумя группами, включая особые осложнения при трансплантации, такие как реакция «трансплантат против хозяина», веноокклюзионная болезнь печени и т.д. Динамические изменения функции печени и почек после трансплантации соответствовали ожиданиям. Причины развития и частота нарушения функции печени и почек мало отличались в двух группах. Не было отмечено негативного влияния рчТП на приживление нейтрофильных гранулоцитов после трансплантации, что указывает на отсутствие конкуренции между рчТП и Г-КСФ на стволовые клетки [12]. Систематическое исследование показало, что частота раннего временного появления антител в низких титрах после использования рчТП составляла всего 3,5–3,7%, нейтрализирующие антитела практически не синтезировались [13–15]. В нашем исследовании также не было обнаружено антител при обследовании части пациентов, поэтому нет необходимости беспокоиться при использовании рчТП при алло-ТГСК.
При химиотерапии солидных опухолей, вызывающей миелосупрессию, назначение ПЭГ-чТП или рчТП может повышать минимальное значение тромбоцитов, сокращать время тромбоцитопении (≤20×109/л) [10, 11, 16, 17], а рчТП также снижает потребность в переливании тромбоцитарной взвеси [14, 17]. Однако в клинических исследованиях начальной и последующей химиотерапии острого лейкоза с более интенсивной миелосупрессией и ауто-ТГСК эти эффекты, вероятно, не проявлялись [9, 18] по необъяснимой причине. Одним из возможных объяснений является то, что уровень эндогенного ТП в сыворотке имеет значительную отрицательную корреляцию с количеством тромбоцитов, а при алло-ТГСК и ауто-ТГСК эта связь четко прослеживается [19, 20]. В случае, когда эндогенная концентрация ТП была очень высокой, эффект экзогенного ТП ограничен. Наши результаты показали, что рчТП не сокращает время восстановления тромбоцитов до ≥20×109/л и 50×109/л, но заметно сокращает время восстановления тромбоцитов до ≥100×109/л, что указывает на медленный и ограниченный эффект рчТП.
ТП в основном действует на ранние клетки-предшественники мегакариоцитов, способствует их пролиферации и дифференцировке, но не может ускорить высвобождение тромбоцитов из зрелых мегакариоцитов и, таким образом, не повышает количество тромбоцитов в течение короткого времени [21]. Необходимы новые исследования, чтобы установить, позволит ли более раннее (раньше, чем на 7-й день) назначение рчТП улучшить результаты.
Неоднородность реципиентов алло-ТГСК очень высока, количество факторов, влияющих на восстановление тромбоцитов и потребность в трансфузии тромбоцитарной взвеси, намного больше, чем при химиотерапии и ауто-ТГСК. Также значительной была разница между пациентами с различными заболеваниями. Например, сывороточный уровень ТП у пациентов с тяжелой острой реакцией «трансплантат против хозяина» и веноокклюзионной болезнью печени значительно ниже, чем у пациентов без этих осложнений [22]. На данный момент сложно объяснить механизм действия ТП. В отличие от ауто-ТГСК, в нашем исследовании было обнаружено, что у пациентов основной группы, получавшей рчТП, значительно уменьшилось количество единиц тромбоцитов, перелитых в течение 100 дней. Это может быть связано с экзогенным рчТП или с другими факторами, по которым группы были неоднородными. В общем, у пациентов основной группы потребность в переливании тромбоцитов была снижена на 30%. В случае если данный результат будет подтвержден в дальнейших исследованиях, это позволит снизить расходы в области оказания медицинской помощи данной категории пациентов.
Пересадка большего количества CD34+-клеток связана с более быстрым восстановлением тромбоцитов [23], и результаты в контрольной группе также это подтверждают. Интересно, что введение экзогенного рчТП дополнительно потенциирует влияние трансплантации большего количества CD34+-клеток, тем временем компенсируя восстановление тромбоцитов у тех пациентов, которым пересадили меньшее количество CD34+-клеток. Данная тенденция отражается на потребности в переливании тромбоцитарной взвеси. У нас есть основания полагать, что, будучи клетками-мишенями для рчТП, количество гемопоэтических стволовых клеток/клеток-предшественников является одним из основных действующих факторов рчТП. Другим объяснением незначительного эффекта рчТП при ауто-ТГСК считается то, что в нем отсутствуют клетки-мишени костного мозга, на которые можно повлиять [8]. Мы предполагаем, что аутогематопоэтические стволовые клетки / клетки-предшественники были повреждены предшествующей химиотерапией и поэтому слабо реагируют на экзогенный рчТП, в то время как при алло-ТГСК гемопоэтические стволовые клетки-предшественники получают от нормальных доноров, и после трансплантации в костный мозг пациентов они могут более эффективно отвечать на стимуляцию рчТП.
Это рандомизированное открытое контролируемое и одноцентровое клиническое исследование указывает, что рчТП медленно и мягко способствует восстановлению тромбоцитов после алло-ТГСК, уменьшает количество перелитых единиц тромбоцитов и безопаснее в использовании. Такие результаты дают основание для дальнейшей оптимизации дизайна и расширения масштабов клинического исследования.
В последние годы хорошие результаты показали исследования с использованием некоторых аналогов ТП в лечении ИТП и связанной с гепатитами тромбоцитопении. Следует ожидать также и клинические испытания так называемых тромбоцитарных факторов роста второго поколения у пациентов, получивших алло-ТГСК.
ЛИТЕРАТУРА
- Nashra, Takatua, Fengz, et al. Effect of c-mpl ligands after total body irradiation (TBI) with and without allogeneic hematopoietic stem cell transplantation: low-dose TBI does not prevent sensitization [J] Biol Blood Marrow Transplant, 2002, 8: 360-367.
- Tepler I, Elias L, Smith Jw Ii, et al. A randomized placebo controlled trial of recombinant human interleukin-11 in cancer patients with severe thrombocytopenia due to chemotherapy [J]. Blood, 1996, 87: 3607-3614.
- Wendling F, Maraskovsky E, Debili N, et al. Mpl ligand is a humoral regulator of megakaryocytopoiesis [J]. Nature, 1994, 369:571-574.
- Abath Df, Kaushansky K, Broudy Vc, et al. Deletion of the extracellular membrane-distal cytokine receptor homology module of Mpl results in constitutive cell grouth and loss of thrombopoietin binding [J]. Blood, 1999, 94: 365-367.
- Nash Ra, Kurzrock R, Dipersio J, et al. A phase I trial of recombinant human thrombopoietin in patients with delayed platelet recovery after hematopoietic stem cell transplantation [J]. Biol Blood Marrow Transplant, 2000, 6: 25-34.
- Fields Kk, Crump M, Bence-Bruckler I, et al. Use of pegylated recombinant human megakaryocyte growth and development factor in platelet engraftment after autologous stem cell transplantation [J]. Bone Marrow Transplant, 2000, 26: 1083-1088.
- Sun Huiping, Shen Zhixiang, Qian Liumei, et al. Effect of multiple recombinant cytokines on proliferation of human megakarycytes [J]. Journal of Shanghai Second Medical University,1997, 17: 170.
- Kuter Dj. New thrombopoietic growth factors [J]. Blood, 2007, 109: 4607-4616.
- Schiffer Ca, Miller K, Larson Ra, et al. A double-blind, placebo-controlled trial of pegylated recombinant human megakaryocyte growth and development factor as an adjunct to induction and consolidation therapy for patients with acute myeloid leukemia [J]. Blood, 2000, 95: 2530-2535.
- Fanucchi M, Glaspy J, Crawford J, et al. Effects of polyethylene glycol-conjugated recombinant human megakaryocyte growth and development factor on platelet counts after chemotherapy for lung cancer [J]. N Engl J Med, 1997, 336: 404-409.
- Basser Rl, Rasko Jej, Clarke K, Et al. Randomized, blinded, placebo-controlled phase I trial of pegylated recombinant human megakaryocyte growth and development factor with filgrastim after dose-intensive chemotherapy in patients with advanced cancer [J]. Blood, 1997, 89: 3118-3128.
- Wolff Sn, Herzing R, Lynch J, et al. Recombinant human thrombopoietin (rhTPO) after autologous bone marrow transplantation: a phase I pharmacokinetic and pharmacodynamic study [J]. Bone Marrow Transplant, 2001, 27: 261-268.
- Vadhan-Aj S, Murray Lj, Bueso-Amos C, et al. Stimulation of megakaryocyte and platelet production by a single dose of recombinant human thrombopoietin in patients with cancer[J]. Ann Intern Med, 1997, 126: 673-681.
- Vadhan-Aj S, Verschraegen Cf, Bueso-Amos C, et al. Recombinant human thrombopoietin attenuates carboplastin-induced severe thrombocytopenia and need for platelet transfusions in patients with gynecologic cancer[J]. Ann Intern Med, 2000, 132: 364-368.
- Hua Baoqiang, Zhao Yongqiang, Zhu Tienan, et al. Dynamic monitoring of antibody formation after patient with thrombocytopenia were subcutaneously injected thrombopoietin [J]. Trombosis and Hemostasis, 2005, 11: 59-61..
- Basser Rl, Underhill C, Davis I, et al. Enhancement of platelet recovery after myelosuppressive chemotherapy by recombinant human megakaryocyte growth and development factor in patients with advanced cancer [J]. J Clin Oncol, 2000, 18: 2852-2861.
- Bai Chunmei, Zou Xiaoyang, Zhao Yongqiang, et al. Clinical study of recombinant human trombopoietin in severe thrombocytopenia induced by chemotherapy [J]. Chinese Medical Journal, 2004, 84: 397-400.
- Archimbaud E, Ottamann Og, Yin Ja, et al. A randomized, double-blind, placebo-controlled study with pegylated recombinant human megakaryocyte growth and development factor ( PEGrHuMGDF) as an adjunct to chemotherapy for adults with de novo acute myeloid leukemia[J]. Blood, 1999, 94: 3694-3701.
- Ishida A, Miyakawa Y, Tanosaki, et al. Circulating endogenous thrombopoietin, interleukin-3, interleukin-6 and interleukin-11 levels in patients undergoing allogeneic bone marrow transplantation [J]. Intern J Hematol, 1996, 65: 61-69.
- Shimazaki C, Inaba T, Uchiyama H, et al. Serum thrombopoietin levels in patients undergoing autologous peripheral blood stem cell transplantation[J]. Bone Marrow Transplant, 1997, 19: 771-775.
- Kuter Dj, Begley Cg. Recombinant human thrombopoietin: basic biology and evalution of clinical studies [J]. Blood, 2002, 100:3457-3469.
- Hamaguchi M, Yamada H, Morishima Y, et al. Serum thrombopoietin levels after allogeneic bone marrow transplantation: possible correlations with platelet recovery, acute graft-versus-host disease and hepatic veno-occlusive disease[J]. Intern J Hematol, 1996, 64: 241-248.
- Keever-Taylor Ca, Klein Jp, Eastwood D, et al. Factors affecting neutrophil and platelet reconstitution following T cell-depleted bone marrow transplantation: differential effects of growth factor type and role of CD34 + cell dose[J]. Bone Marrow Transplant, 2001, 27: 791-800.
Chinese Journal of Thrombosis and Hemostasis 2011 Vol 17 No 6 Перевод предоставлен Сукач Мариной, Безродной Александрой.
