Важность назначения рекомбинантного человеческого тромбопоэтина до курса химиотерапии для снижения ассоциированной с ним ранней тромбоцитопении.
Importance of Predosing of Recombinant Human Thrombopoietin to Reduce Chemotherapy-Induced Early Thrombocytopenia.
Сародж Вадхан-Рай, Шреяскумар Пател, Карлос Буесо-Рамос, Йоды Фоллодер, Николас Пападополоус, Эндрю Бургесс, Лиль Д. Броемелинг, Хал Е. Брохмейер, Роберт С. Бенджамин.
By Saroj Vadhan-Raj, Shreyaskumar Patel, Carlos Bueso-Ramos, Jody Folloder, Nicholas Papadopolous, Andrew Burgess, Lyle D. Broemeling, Hal E. Broxmeyer, and Robert S. Benjamin.
Резюме
Цель. Рекомбинантный человеческий тромбопоэтин (рчТП) повышает уровень тромбоцитов. Тем не менее максимальный ответ на препарат несколько отсрочен во времени, поэтому введение после химиотерапии не демонстрирует одинаковую эффективность. Целью данного исследования было подобрать эффективную схему назначения рчТП для оптимальной коррекции ранней тромбоцитопении.
Пациенты и методы. Когорты из шести пациентов с саркомой (66 пациентов) получали последовательно доксорубицин и ифосфамид (ДИ) в сочетании с рчТП в фиксированной дозировке с различной схемой назначения до и/или после химиотерапии в цикле 2 и последующих циклах. Цикл 1, в котором рчТП не назначался, служил в качестве внутреннего контроля.
Результаты. ДИ вызывает кумулятивную тромбоцитопению. Самый низкий уровень тромбоцитов (надир тромбоцитов), полученный в цикле 2, оказался выше, чем в цикле 1 (119±12.103/мкл против 80±7.103/мкл соответственно, р<0,001), у 24 (80%) из 30 пациентов (р<0,001), которым рчТП (из расчета 1,2 мкг/кг) назначался за 5 дней до начала химиотерапии (до/после курса, три/один или один/один), по сравнению с 4 (17,0%) из 24 пациентов, получавших рчТП по другим схемами (до/после курса, два/два, один/три, ноль/четыре или четыре/ноль), и ни одним из 15 пациентов контрольной группы. Потребность в переливании тромбоцитов в четырех циклах была значительно ниже (13 (11%) из 114 циклов, р<0,001) у пациентов, получавших рчТП с 5-го дня (до/после курса, три/один или один/один), по сравнению с пациентами, которые получали рчТП в более поздние сроки (28 (47%) из 60 циклов).
Отмечено, что количество мегакариоцитов костного мозга заметно возрастает (в 4 раза) до начала химиотерапии при предварительном назначении рчТП и остается повышенным (в 2 раза) по окончанию химиотерапии, что может объяснить возможный механизм ответа. У одного пациента наблюдалось развитие тромбоза подключичной вены, образование нейтрализующих антител к рчТП не отмечено ни в одном случае.
Выводы. Результаты демонстрируют важность сроков назначения рчТП по отношению к химиотерапии и показывают, что при оптимальном подборе сроков назначения требуется только две дозы рчТП (один до и один после химиотерапии) для значительного снижения тяжести ассоциированной с химиотерапией ранней тромбоцитопении.
Тромбоцитопения, ассоциированная с химиотерапией, увеличивает риск развития геморрагических осложнений, повышает потребность в трансфузии тромбоцитов и ограничивает дозы цитотоксических агентов, применяемых в лечении некоторых злокачественных новообразований. В настоящее время переливание тромбоцитарной массы является основным методом лечения тяжелой тромбоцитопении [1–3], однако оно ассоциировано с рядом потенциальных осложнений, таких как повышенный риск присоединения вторичных инфекций, аллоиммунизация и увеличение расходов на здравоохранение. Как следствие, были разработаны протоколы, основанные на доказательной базе, для проведения трансфузии тромбоцитарной массы [4] и продолжен поиск безопасных и эффективных стратегий для коррекции тромбоцитопении, ассоциированной с химиотерапией. За последние десятилетия прошли клинические испытания ряда тромбопоэтических цитокинов и факторов роста [5–10]. К сожалению, многие из них продемонстрировали умеренную активность и значительную токсичность. Для лечения тромбоцитопении был одобрен интерлейкин-11, тем не менее его терапевтический индекс ограничен [10, 11].
Тромбопоэтин является главным регулятором развития мегакариоцитов и тромбоцитов [12–14]. Ранние клинические исследования двух форм рекомбинантного белка (полноразмерной молекулы, рекомбинантного человеческого тромбопоэтина (рчТП), и укороченной, пегилированного рекомбинантного человеческого мегакариоцитарного фактора роста) продемонстрировали дозозависимое увеличение числа циркулирующих тромбоцитов при назначении без химиотерапии [15–17]. Назначение обоих молекул после курса химиотерапии повысило восстановление тромбоцитов и уменьшило частоту возникновения тромбоцитопении после назначения умеренно миелосупрессивных схем химиотерапии [15, 17–20]. Однако клиническая разработка пегилированного рекомбинантного человеческого мегакариоцитарного фактора роста в Соединенных Штатах была прекращена из- за развития нейтрализующих антител и тяжелой тромбоцитопении у некоторых раковых пациентов и здоровых доноров. Кроме того, их использование в виде нескольких доз после курса химиотерапии (до 20 доз) после более интенсивных режимов химиотерапии не равномерно уменьшает выраженность тромбоцитопении или потребность в трансфузии тромбоцитарной массы за исключением пациентов, получающих карбоплатин [17–20]. Положительный эффект применения рчТП после курса карбоплатина может быть связан тем, что карбоплатин вводится только 1 день и приводит к позднему развитию надира тромбоцитов (около 16-го дня), что создает требуемую задержку времени для формирования тромбоцитов из рчТП- чувствительных клеток-предшественников [20].
Некоторые исследования показали, что введение рчТП до курса химиотерапии может оказывать положительный эффект. Например, многие схемы терапии назначаются курсом в течение от 3 до 5 дней и приводят к раннему развитию надира тромбоцитов (от 10-го до 14-го дня) [21, 22]. Увеличение тромбоцитов после пика рчТП наблюдается приблизительно к 12-му дню [16, 17]. Таким образом, назначение рчТП после курса химиотерапии не приведет к оптимальному воздействию на развитие раннего надира тромбоцитов, ассоциированного со многими режимами химиотерапии. Поэтому мы считаем, что для режимов химиотерапии с ранними побочными реакциями предшествующее назначение рчТП может увеличить пул зрелых мегакариоцитов до химиотерапии, а это в свою очередь приведет к достаточному увеличению числа тромбоцитов. В дополнении назначение рчТП после курса химиотерапии может ускорить время восстановления и стабилизации надира тромбоцитов.
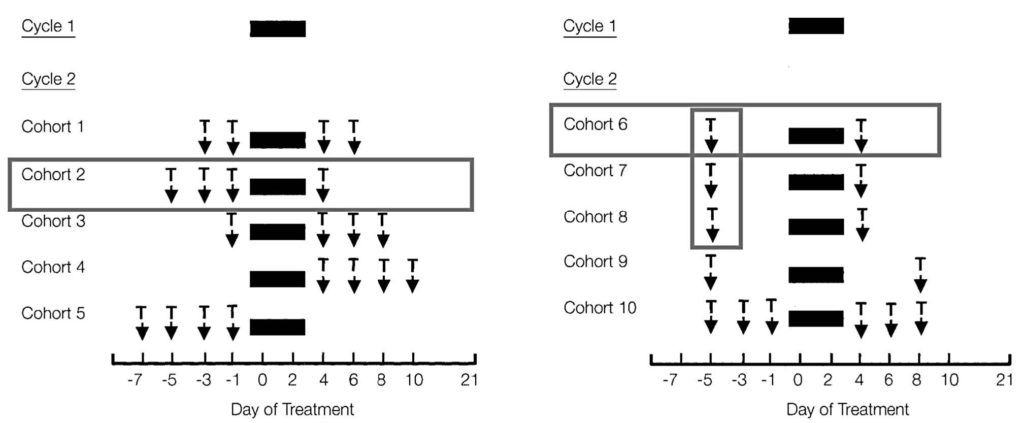
Рис. 1. (А) Схемы исследования для фазы подбора режима терапии. Цикл 1 химиотерапии (от 0 до 3-го дня) не включал рекомбинантный человеческий тромбопоэтин (рчТП). Цикл 2 и последующие циклы: рчТП назначался из расчета 1,2 мкг/кг в виде 4 доз до, после химиотерапии и до и после химиотерапии, как показано на рис. Интервал между циклами составил 21 день. (В) Схемы для фазы оптимизации режима терапии. В цикле 2 рчТП вводили в виде 2 доз до начала курса химиотерапии (дни -5 и 4) из расчета 1,2 мг/кг (когорта 6), 2,4 мг/кг (когорта 7) и 3,6 мг/кг (когорта 8) и после курса терапии из расчета 1,2 мкг/кг; также в виде 2 доз (дни от -5 и 8, когорта 9), 6 доз (дни -5, -3, -1, 4, 6 и 8; когорта 10) из расчета 1,2 мг/кг.
Проведено клиническое исследование рчТП у пациентов с саркомой, которые получали интенсивную химиотерапию и были подвержены высокому риску кумулятивной тяжелой тромбоцитопении [18]. Целью данного исследования было установить эффективную схему назначения рчТП для ослабления кумулятивной тромбоцитопении, связанной с комбинированной химиотерапией, а также изучить возможные механизмы воздействия на уровне клетки-предшественника, который мог бы объяснить природу реакции и эффект оптимальной схемы лечения. Кроме того, была проведена оценка профиля клинической безопасности и потенциальное влияние на иммуногенность после нескольких циклов лечения с использованием рчТП.
Пациенты и методы
Пациенты. В фазу I/II клинического исследования были включены наивные пациенты с саркомой, у которых не было противопоказаний к проведению химиотерапии, в возрасте от 15 до 65 лет, удовлетворительным общим состоянием по шкале Карновского и не нарушенными функциями почек, печени и костного мозга. Из исследования были исключены пациенты, у которых в анамнезе имелась лучевая терапия органов малого таза, хирургическое вмешательство в течение последних 2 недель, тромбоэмболический или геморрагический синдром, выраженная сердечная недостаточность. У всех пациентов перед началом исследования получено письменное информированное согласие.
Клинический и лабораторный мониторинг. Во время проведения исследования у всех пациентов оценивались данные объективного осмотра, лабораторных и инструментальных показателей, включая общий анализ крови (3 раза в неделю и ежедневно в случае надира тромбоцитов), биохимический анализ крови плюс электролиты, общий анализ мочи, рентген органов грудной клетки, ЭКГ и рентгенологическое измерение размеров опухоли [16]. Дополнительно образцы сыворотки тестировались методом ИФА на наличие антител к тромбопоэтину до начала терапии и после каждого цикла лечения. Наличие нейтрализующих антител определялось по присутствию ингибирующего эффекта в сочетании с клинически значимой тромбоцитопенией [16].
Биопсия костного мозга проводилась при наличии согласия пациента до и после назначения рчТП с химиотерапией или без нее.
Рекомбинантный человеческий тромбопоэтин. РчТП, который использовался в данном исследовании, представляет собой полноразмерную гликозилированную молекулу (Genentech Inc., Сан-Франциско, штат Калифорния) предоставленный компанией Pharmacia Corporation (Пипак, штат Нью-Джерси).
Химиотерапия. Доксорубицин (общая доза, 90 мг/м2) вводился внутривенно капельно (дни с 0 по 2-й), ифосфамид (общая доза, 10 г/м2) в виде 3-часовой внутривенной инфузии (дни с 0 до 3-го). Месна в стандартной дозировке вводилась болюсно в виде непрерывной внутривенной инфузии в течение 24 ч после введения последней дозы ифосфамида (дни с 0 до 4-го). Дозы химиотерапии были фиксированными в течение первых двух циклов для лучше.
Дизайн исследования. Исследование было проведено в два этапа: фазы подбора режима терапии и фазы оптимизации режима терапии.
Фаза подбора режима терапии. Цикл 1 химиотерапии (дни от 0 до 3-го) не включал назначение рчТП и служил внутренним контролем. Три недели спустя пациенты получили второй курс химиотерапии в тех же дозах (цикл 2) с рчТП по схеме, описанной далее. Пациенты пяти когорт получали лечение в инициальной фазе подбора терапии (рис. 1А). В этой фазе пациенты получали четыре дозы рчТП из расчета 1,2 мкг/кг: 2 дозы до курса химиотерапии и две дозы после курса (дни -3, -1, 4 и 6) для когорты 1; в виде 3 доз до курса и одной – после курса (дни -5, -3, -1 и 4) для когорты 2; в виде одной дозы до курса и трех – после курса (дни –1, 4, 6 и 8) для когорты 3; в виде всех 4 доз после курса (дни 4, 6, 8 и 10) для когорты 4; в виде всех 4 доз до курса (дни -7, -5, -3 и -1) для когорты 5.
Фаза оптимизации режима терапии. После установления наиболее эффективного режима (т.е. три дозы до курса и одна после курса) хотелось выявить влияние дозировки препарата от сроков назначения (рис. 1B). Следующие три когорты получали две дозы рчТП одновременно в один день до курса химиотерапии (-5) и две дозы в один день после курса (4). РчТП до курса химиотерапии назначался из расчета 1,2 мкг/кг (когорта 6), 2,4 мкг/кг (когорта 7) и 3,6 мкг/кг (когорта 8). После курса химиотерапии доза рчТП оставалась во всех когортах постоянной (1,2 мкг/кг). Для определения целесообразности дополнительного введения рчТП после 4-го дня химиотерапии исследовались еще две когорты (рис. 1В). РчТП назначался в качестве одной дозы до курса и одной – после курса (дни -5 и 8) в когорте 9 и в виде трех доз до курса и трех после курса (дни -5, -3, -1, 4, 6, и 8) в когорте 10.
Когорта из шести пациентов последовательно получала каждый из режимов терапии. Дополнительно еще шесть пациентов получали лечение по схеме (когорта 2), которая показала себя как наиболее перспективная по результатам фазы подбора схемы терапии. Пациенты со стабильным течением болезни или течением, отвечающим на терапию, после двух циклов лечения получали четыре дополнительных цикла с рчТП в той же дозировке и по той же схеме.
Все пациенты получали гранулоцитарный колониестимулирующий фактор (гКСФ, 5 мкг/кг/сут.), который назначался на 4-й день и продолжался до восстановления уровня нейтрофилов (>1500/мкл в течение 2 последующих дней после надира). Другие гемопоэтические факторы роста, включая эритропоэтин и гранулоцитарно- макрофагальный фактор, в исследовании не использовались.
Переливание тромбоцитарной массы проводилось пациентам при развитии тяжелой тромбоцитопении (количество тромбоцитов <15000/мкл); эритроцитарной массы при снижении гемоглобина <7 г/дл или по другим клиническим показаниям.
Статистические методы. Гемопоэтическую токсичность цикла 1 химиотерапии (без рчТП) сравнивали с результатами цикла 2 (с рчТП), используя парный критерий Стьюдента для непрерывно измеряемых величин (степень и продолжительность тромбоцитопении и время восстановления тромбоцитов). Также были использованы критерий χ2 и регрессионный анализ.
Результаты
В общей сложности в исследование было включено 73 пациента. Из них двое из-за отсутствия гистологического подтверждения саркомы были исключены. Таким образом, были проанализированы результаты 71 пациента (31 мужчина и 40 женщин) с саркомой различных гистологических подтипов. Средний возраст составил 47 лет (диапазон от 18 до 65 лет), медиана оценки общего состояния по шкале Карнофски – 90% (диапазон от 80 до 100). 5 из 71 пациентов были расценены как несоответствующие критериям оценки гемопоэтического ответа: двоим из них не назначался рчТП из-за застойной сердечной недостаточности (один пациент) и смерти, связанной с основным заболеванием (один пациент), в цикле 1. Еще трое пациентов были расценены как соответствующие критериям оценки токсичности только потому, что один пациент нуждался в снижении дозы химиотерапии после одного цикла из-за плохой переносимости, двое пациентов нуждались в модификации дозы рчТП вследствие существенного тромбоцитоза (у одного пациента) или тромбоза подключичной вены (один пациент).
Влияние рчТП на тромбоцитопению. Фаза подбора режима терапии. Назначение доксорубицина и ифосфамида (ДИ) приводит к развитию кумулятивной тромбоцитопении [23]. В предыдущем исследовании было показано, что назначение ДИ в тех же дозах (без рчТП) приводит к более низкому надиру тромбоцитов в цикле 2 по сравнению с циклом 1 (51±10.103/мкл против 80±14.103/мкл соответственно, р=0,001) у всех 15 пациентов (рис. 2, исторический контроль). В фазе подбора режима терапии этого исследования надир тромбоцитов в цикле 2 (с рчТП) был ниже, чем в цикле 1 (без рчТП) у 19 (79,0%) из 24 пациентов, у которых рчТП назначался в виде двух доз до курса и двух доз после курса химиотерапии (когорта 1), одной до курса и трех после курса (когорта 3), всех доз после курса (когорты 4) и всех доз до курса (когорта 5, рис. 2). При этом надир тромбоцитов в цикле 2 был ниже, чем в цикле 1 только у 2 (17,0%) из 12 пациентов (р=0,009), которые получали рчТП в виде трех доз до курса и одной дозы после курса химиотерапии (когорта 2). При сравнении надира тромбоцитов в цикле 2 и цикле 1 когорт 1–5 с помощью одностороннего дисперсионного анализа была выявлена существенная разница (р=0,001). В дальнейшем менее существенное различие процедуры множественного сравнения показало, что средняя разница в когорте 2 была наибольшей и существенно отличалась от остальных четырех когорт.
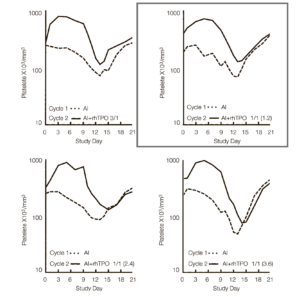
Кинетика надира тромбоцитов и их восстановления в течение двух циклов химиотерапии показаны на рис.3.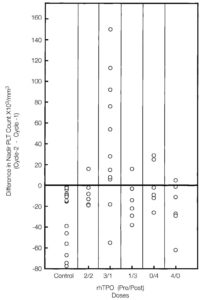
Рис. 2. Влияние рекомбинантного человеческого тромбопоэтина (рчТП) на кумулятивную тромбоцитопению. Показана разница величины надира тромбоцитов (цикл 2 и 1) в исторической когорте пациентов, которая получала те же дозы химиотерапии без рчТП, и когорте 5, которая получала 4 дозы рчТП (1,2 мг/кг) до/после курса в цикле 2.
Надир тромбоцитов был ниже в цикле 2 по сравнению с циклом 1 в исторической когорте пациентов (рис. 3А) и во всехкогортах, которые получали рчТП, за исключением когорты 2 (рис. 3С, табл. 1). В этой когорте назначение рчТП за 5 дней до начала цикла 2 привело к развитию раннего тромбоцитоза с последующим более высоким надиром тромбоцитов (среднее значение надира тромбоцитов ± стандартная ошибка, 83±14.103/мкл против 123±21.103/мкл в циклах 1 и 2 соответственно, р=0,036) и раннему восстановлению тромбоцитов (рис. 3, табл. 1). Эти результаты подтверждают целесообразность назначения рчТП до курса терапии и его оптимальные сроки (начиная с дня -5) по отношению к химиотерапии для снижения степени выраженности тромбоцитопении. В когорте 5 (рис. 3F), где рчТП назначался только в виде 4 доз до курса химиотерапии, также отмечено развитие раннего тромбоцитоза, при этом степень выраженности надира не уменьшалась, а восстановление в цикле 2 проходило медленнее (рис. 3). Эти данные указывают на важность назначения рчТП по завершении химиотерапии.
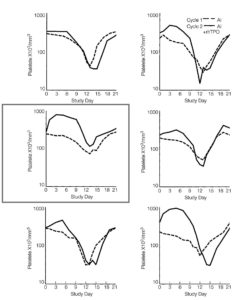
Рис. 3. Влияние рекомбинантного человеческого тромбопоэтина (рчТП) на кинетику надира тромбоцитов и их восстановление. (A) Контрольная группа; (B) рчТП (до/после курса) 2/2; (C) рчТП (до/после курса) 3/1; (D) рчТП (до/после курса) 1/3; (E) рчТП (до/после курса) 0/4; (F) рчТП (до/ после курса) 4/0. Медиана количества тромбоцитов в цикле 1 (_ _ _, только химиотерапия) и цикле 2 (___, химиотерапия плюс рчТП в дозировке 1,2 мкг/кг в виде 4 доз). 3А показывает количество тромбоцитов в исторической контрольной группе, которые получали одни и те же дозы химиотерапии без рчТП. ДИ, доксорубицин и ифосфамид.
Таблица 1
Влияние рекомбинантного человеческого тромбопоэтина на ассоциированную с химиотерапией миелосупрессию
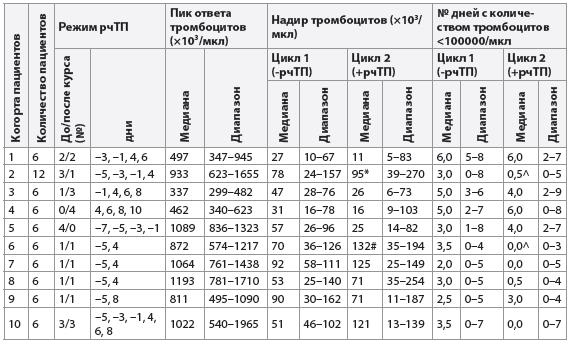
Таблица 1
Влияние рекомбинантного человеческого тромбопоэтина на ассоциированную с химиотерапией миелосупрессию (продолжение)
Примечания:
рчТП – рекомбинантный человеческий тромбопоэтин;
* – p=0,036;
# – p=0,005;
^ – p≤0,070.
Рис. 4. Оптимизация применения рчТП перед курсом химиотерапии. Среднее количество тромбоцитов в цикле 1 (- — -) и цикле 2 (–––) у пациентов, получавших рчТП начиная с –5 дня в виде 3 доз до химиотерапии и 1 после химиотерапии (рис. 4А) или 1 до и 1 после химиотерапии (рис. 4В – в дозе 1,2 мкг/кг, рис. 4С – 2,4 мкг/кг, рис. 4D – 3,6 мкг/кг). ДИ – доксорубицин и ифосфамид, рчТП – рекомбинантный человеческий тромбопоэтин.
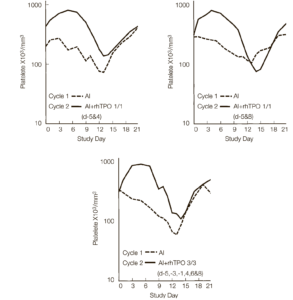
Фаза оптимизации режима терапии. Учитывая важность сроков введения рчТП до начала химиотерапии, можно сделать вывод, что введение одной дозы в день –5 может оказаться столь же эффективным, как и введение трех доз в дни –5, –3 и –1. Поэтому было набрано еще три дополнительные когорты пациентов. РчТП назначался в виде одной дозы (из расчета 1,2 мг/кг, 2,4 мг/кг или 3,6 мг/кг) в день –5 и однократно после курса химиотерапии (из расчета 1,2 мг/кг) на 4-й день (рис. 1В).
Рис.5. Оптимизация применения рекомбинантного человеческого тромбопоэтина (рчТП) после курса химиотерапии. Среднее количество тромбоцитов в цикле 1 (- — -) и цикле 2 (––) у пациентов, получавших 1 дозу до/1 после (-5 день и 4 [рис.А]; и -5 день и 8 [рис.В]) или 3 дозы до/3 после (-5, -3, -1, 4, 6 и 8 день, рис.С). ДИ – доксорубицин и изосфамид.
В этих когортах (когорты 6, 7 и 8), надир тромбоцитов в цикле 2 оказался выше, чем в цикле 1 (среднее значение ± стандартная ошибка, 116±15.103/мкл против 78±8.103/мкл соответственно; p<0,001) у 14 из 18 пациентов (табл. 1). Кинетика ответа тромбоцитов на введение рчТП на –5 день однократно в дозировке 1,2 мг/ кг (когорта 6) была сопоставимой (рис. 4В) с результатом, наблюдаемым в когорте 2 (рис. 4A), где рчТП назначался в виде трех доз до курса (из расчета 1,2 мкг/кг). В этой группе надир тромбоцитов в цикле 2 оказался значительно выше, чем в цикле 1 (среднее значение ± стандартная ошибка, 132±23.103/мкл против 77±14.103/мкл соответственно; р=0,005). Величина (табл. 1) и кинетика ответа были сходными при дозировке 2,4 и 3,6 мкг/кг докурсовой дозы рчТП (рис. 4С, D). Эти результаты еще раз подтвердили важность правильного подбора сроков введения рчТП до начала курса химиотерапии и показали, что однократное введение рчТП (из расчета 1,2 мкг/ кг) в оптимальные сроки оказывает схожий биологический эффект с трехкратным введением рчТП (1,2 мкг/кг), а более высокие дозировки (2,4 или 3,6 мкг/кг) не оказывают значительного преимущества.
Оптимизация применения рчТП после курса химиотерапии. Были сформированы две дополнительные когорты, получавшие рчТП (1,2 мг/кг): когорта 9, получавшая его до химиотерапии в –5-й день и 8-й день по окончанию химиотерапии, и когорта 10, получавшая его в –5, –3 и –1 дни до химиотерапии и три дозы в день 4-й, 6-й и 8-й по окончанию химиотерапии, чтобы определить, влияет ли отсрочка или продолжение применения рчТП после курса химиотерапии до 8 дня на улучшение надира тромбоцитов и их восстановление. Как показано на рис. 5, отсрочка введения рчТП до 8-го дня по окончанию курса химиотерапии (когорта 9; рис. 5В) задерживает восстановление количества тромбоцитов и углубляет надир тромбоцитов (табл. 1). У четырех из шести пациентов надир тромбоцитов был ниже в цикле 2, чем в цикле 1. Этот результат подтверждает важность раннего назначения рчТП после курса химиотерапии. Как показано на рис. 5, кинетика надира тромбоцитов и восстановления их количества в когорте, получавшей 6 доз рчТП (три во время химиотерапии и три после химиотерапии, рис. 5С) были подобны им в когорте, получавшей 2 дозы (одна доза до химиотерапии в –5-й день и одна доза в 4-й день по окончании химиотерапии; рис. 5А). Несмотря на то, что в среднем надир тромбоцитов был выше в цикле 2, чем в цикле 1 (табл. 1), у двух из шести пациентов его значение было ниже. Эти данные показывают, что более частое применение рчТП не обеспечивает никаких дополнительных преимуществ в снижении степени тромбоцитопении.
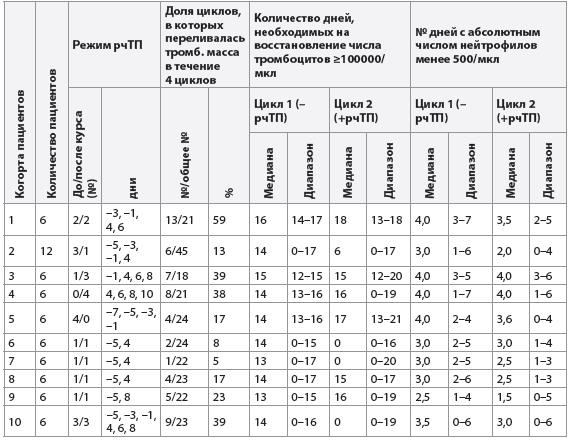
Влияние рчТП на потребность в переливании тромбоцитарной массы. Для того чтобы оценить влияние рчТП на развитие кумулятивной тромбоцитопении, была проанализированао потребность в трансфузиях тромбоцитарной массы, принимая во внимание отношение количества циклов, во время которых была проведена трансфузия, к общему количеству циклов – 4 (табл. 1). В целом во время 59 из 243 циклов потребовалось переливание тромбоцитов; в 71% случаев среди них трансфузия проводилась в 3-м и 4-м циклах. Во время 97% этих циклов (235 из 243 циклов) химиотерапевтические препараты были введены в полной дозе. И только в 3% из них потребовалось снизить дозу доксорубицина до 75 мг/ м2 в 4-м цикле по причине тяжелого мукозита. Потребность в переливании тромбоцитов в течение четырех циклов была ниже (17 (12%) из 138 циклов, р<0,001) в когортах пациентов (когорты 2, 5, 6, 7 и 8), которые получали рчТП начиная с –5 дня (в режимах три дозы до / одна доза после курса химиотерапии или одна доза до / одна доза после химиотерапии) или с –7 дня (все четыре дозы до курса химиотерапии), по сравнению с потребностью в когортах (когорты 1, 3 и 4), которые получали рчТП позже: с –3 или –1 дня до химиотерапии или все дозы после химиотерапии (28 (47%) из 60 циклов; рис. 6А). Отмечалась тенденция к увеличению количества трансфузий тромбоцитарной массы среди пациентов, которым было отсрочено введение рчТП после курса химиотерапии (когорта 9) или продолжено до 8-го дня (когорта 10, таблица 1). Данные когорты не были сопоставимы по степени тромбоцитопении во время 1-го цикла химиотерапии. Таким образом, чтобы определить, связано ли различие в необходимости трансфузии тромбоцитарной массы с врожденными особенностями чувствительности костного мозга, были проанализированы лишь те пациенты, у которых во время 1-го цикла развилась тромбоцитопения не менее 3-й степени (с минимальным снижением количества тромбоцитов <50.109/л) (рис. 6). Подобная тенденция отмечалась у пациентов 2, 5, 6, 7 и 8-й когорт, которым потребовалось меньше трансфузий (11 (23%) из 47 циклов, р=0,009), чем пациентам других когорт (26 (59%) из 44 циклов для когорт 1, 3, и 4; 3 (43%) из 7 циклов для когорты 9 и 5 (45%) из 11 циклов для когорты 10). При расчете критерия χ2 было доказано, что самая низкая доля циклов, требующих переливания тромбоцитарной массы, среди всех 10 когорт исследования наблюдалась в когорте 7 (р<0,001). Кроме того, с помощью регрессионного анализа было установлено отсутствие существенного влияния значения надира тромбоцитов в цикле 1 на значение в цикле 2 (p=0,208).
Влияние на другие ростки кроветворения
Нейтропения. Все пациенты получали гКСФ с 1 цикла данного исследования. У всех пациентов наблюдали развитие нейтропении 4-й степени (надир нейтрофилов, <500/ мкл). Тяжелая нейтропения сохранялась несколько дольше в цикле 1 по сравнению с циклом 2 (3,5±0,2 дней против 2,8±0,2 дней; р=0,015). В то же время частота нейтропенической лихорадки, требующей назначения антибиотиков, существенно не отличалась в двух циклах (41% в цикле 1 против 47% в цикле 2). Таким образом, рчТП не уменьшает биологический эффект гКСФ на гранулоцитарный росток.
Анемия. Анемия имела кумулятивный характер. Доля пациентов, требующих трансфузии эритроцитарной массы, существенно не отличалась среди различных когорт (р=0,255, рис. 6). В целом потребность в переливании эритроцитарной массы в четырех циклах составила 45%.
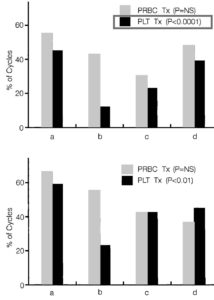
Рис. 6. Доля циклов, во время которых пациенты нуждались в трансфузии (Tx) эритроцитарной (PRBC) или тромбоцитарной массы (PLT). (А) изображены данные всех пациентов (n=66), (B) данные только тех пациентов, у которых развилась тромбоцитопения 3-й и более степени во время цикла 1 (n=30).
Примечания:
а – рчТП начиная с –3, –1 или 4-го дня (когорты 1, 3 и 4);
в – рчТП начиная с –5-го дня (когорты 2, 6, 7 и 8) или –7-го (когорта 5);
с – назначение рчТП было отложено до 8-го дня по окончании химиотерапии (когорта 9);
d – применение рчТП после химиотерапии продолжалось до 8-го дня (когорта 10).
NS – не имеет достоверного значения.
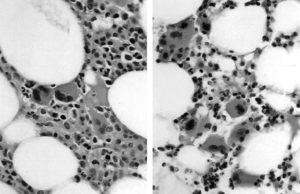
Рис. 7. Микрофотографии пунктата костного мозга пациента. (A) До химиотерапии + рчТП: костный мозг содержит миелоидные и мегакариоцитарные клеточные элементы. (B) После химиотерапии + рчТП: заметное снижение количества миелоидных элементов, и наоборот – значительное увеличение количества зрелых мегакариоцитов.
Влияние на костный мозг. Было проведено морфологическое исследование пунктата костного мозга с определением его клеточности и количества мегакариоцитов для уточнения механизма ответа костного мозга на тромбопоэтин. 30 пациентам было проведено 2 исследования миелограммы на двух из трех временных точек (до рчТП и химиотерапии; после рчТП до начала химиотерапии и после химиотерапии и рчТП в цикле 2). Перед началом терапии клеточность и количество мегакариоцитов костного мозга были в пределах нормы у всех пациентов (табл. 2). У пациентов, которые получали рчТП, начиная с –5 или –7-го дня до химиотерапии, наблюдалось заметное увеличение (в 4 раза) количества мегакариоцитов костного мозга (табл. 2), которые имели нормальную морфологию и были преимущественно полиплоидными с зернистой цитоплазмой.
Клеточность костного мозга и количество мегакариоцитов уменьшились после химиотерапии и рчТП (табл. 2). Тем не менее у пациентов, которые получали рчТП перед химиотерапией, начиная с –5-го дня, количество мегакариоцитов было в два раза выше, чем их изначальное значение, и в четыре раза выше, чем у пациентов, получавших рчТП позже (табл. 2). Несмотря на заметное снижение общей клеточности, при микроскопическом исследовании пунктата костного мозга было обнаружено много мегакариоцитов, морфологически похожих на зрелые (рис. 7).
Рис. 7. Микрофотографии пунктата костного мозга пациента. (A) До химиотерапии + рчТП: костный мозг содержит миелоидные и мегакариоцитарные клеточные элементы. (B) После химиотерапии + рчТП: заметное снижение количества миелоидных элементов, и наоборот – значительное увеличение количества зрелых мегакариоцитов.
Таблица 2
Эффект рчТП на мегакариоциты костного мозга
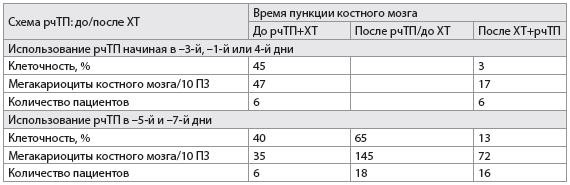
Примечания:
рчТП – рекомбинантный человеческий тромбопоэтин;
ПЗ – поле зрения.
Таблица 3
Побочные эффекты у пациентов при химиотерапии с/без использования рекомбинантного человеческого тромбопоэтина (n=69)
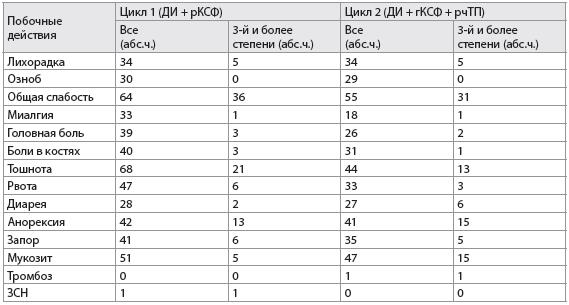
Примечания:
ДИ – доксорубицин и ифосфамид;
гКСФ – гранулоцитарный колониестимулирующий фактор;
рчТП – рекомбинантный человеческий тромбопоэтин;
ЗСН – застойная сердечная недостаточность.
Клиническая переносимость. Побочные эффекты были одинаковы для обоих циклов химиотерапии с использованием или без рчТП (табл. 3). Лечение с использованием рчТП хорошо переносится без каких-либо симптомов, которые могут развиться вследствие приема рчТП, за исключением случая тромбоза правой подключичной и аксилярной вен у одного пациента (когорта 10), который развился, когда количество тромбоцитов составляло 875 000/мкл. Был отменен рчТП, назначены антикоагулянты и устранен тромбоз. У другого пациента (когорта 6), у которого развилась инфекция центрального венозного катетера, при исследовании венозного кровотока было выявлено наличие хронической обструкции подключичной вены. При последующей венографии не было выявлено никаких признаков тромбоза. Кроме того, у одного пациента (когорта 10) развился выраженный тромбоцитоз (количество тромбоцитов – 2.106/мкл) в цикле 2, что требовало снижения дозы рчТП (с 1,2 мкг/кг до 0,3 мкг/кг) при его применении в последующие циклы. У восьми пациентов отмечались случаи кровотечений (носовые, кожные, вагинальные, геморроидальные кровотечения или гематурия). У двоих пациентов отмечались случаи кровотечений 3-й степени (ректальные и носовые), которые требовали гемотрансфузии, при количестве тромбоцитов больше, чем 15 000/мкл.
Проведен анализ на наличие антител к тромбопоэтину (293 образца сыворотки крови). Образцы сыворотки шести пациентов оказались положительными на наличие антител к рецепторам с-MPL при однократном или многократном исследовании. Однако ни один образец не содержал нейтрализирующих антител. Кроме того, у всех пациентов (n=66) данного исследования восстановление количества тромбоцитов до >100 000/ мл произошло в среднем на 21-й день (от 13-го до 36-го дня) после последнего цикла химиотерапии с использованием рчТП.
ОБСУЖДЕНИЕ
Миелосупрессия – частое осложнение при применении цитотоксических препаратов. Одобренные FDA (Food and Drug Administration) миелоидные факторы роста эффективно используются после химиотерапии для коррекции нейтропении и снижения частоты нейтропенической лихорадки [24, 25]. Тем не менее использование рчТП в подобном режиме (многократное введение после химиотерапии) не продемонстрировало достаточную клиническую эффективность [15–20]. Сложность практического применения рчТП может быть частично связана со временем, необходимым для продукции тромбоцитов после стимуляции клеток-предшественников рчТП. Целью исследования было определить время использования рчТП относительно химиотерапии, приняв во внимание кинетику развития минимального снижения тромбоцитов, вызванного химиотерапией, и кинетику ответа тромбоцитов на рчТП, для снижения степени тяжести ранней тромбоцитопении и необходимости в переливании тромбоцитарной массы.
Результаты исследования показывают важность выбора времени назначения рчТП, так как оно оказывает влияние на развитие надира тромбоцитов и их восстановления после интенсивной химиотерапии. Использование схемы ДИ (доксорубицин, ифосфамид) закономерно обуславливает развитие кумулятивной тромбоцитопении. В предыдущем исследовании без использования рчТП, у всех пациентов группы исторического контроля во 2-м цикле химиотерапии развилась более тяжелая тромбоцитопения по сравнению с циклом 1. У 80% пациентов данного исследования, получавших дозу рчТП за 5 дней до начала и дозу после химиотерапии (по схеме три дозы до/одна после химиотерапии или одна доза до/одна после химиотерапии), минимальное количество тромбоцитов было выше в цикле 2, чем в цикле 1, по сравнению с 17% пациентов, которым рчТП назначали позже, что указывает на важность его применения до химиотерапии. Тем не менее у тех пациентов, которые получили все четыре дозы рчТП до химиотерапии и не получали его после (когорта 5), или тех, которые получили рчТП за 5 дней до начала химиотерапии, но у которых было отсрочено введение дозы после химиотерапии на 4 дня (когорта 9), минимальное количество тромбоцитов было ниже, а их восстановление происходило медленнее, несмотря на развитие раннего тромбоцитоза. Таким образом, эти результаты показывают важность подбора оптимального времени как для назначения до, так и после химиотерапии для того, чтобы обеспечить максимальный эффект на значение надира тромбоцитов и длительности их восстановления.
Зависимость положительного эффекта от режима введения рчТП можно объяснить несколькими возможными механизмами. Во-первых, назначение рчТП до начала химиотерапии (начиная с –5-го дня) привело к значительному увеличению числа мегакариоцитов костного мозга до химиотерапии. Таким образом, применение рчТП до химиотерапии расширило резервуар клеток-предшественников тромбоцитов, что привело к увеличению количества тромбоцитов до развития вызванной химиотерапией тромбоцитопении. Во-вторых, учитывая продолжительность жизни тромбоцитов (9–10 дней), следует ожидать незначительную продолжительность эффекта после применения рчТП [16]. В-третьих, несмотря на заметное уменьшение общей клеточности после химиотерапии, количество мегакариоцитов было все еще значительно выше исходного уровня за счет зрелых полиплоидных клеток, что указывает на то, что рчТП защищает мегакариоциты от апоптоза, вызванного химиотерапией. Это подтверждается предыдущими исследованиями, в которых доказывается роль рчТП как фактора, который предотвращает программируемую гибель мегакариоцитов и клеток-предшественников in vitro [26–28]. Таким образом, повышенное количество зрелых мегакариоцитов после химиотерапии может обеспечить дальнейшее увеличение продукции тромбоцитов, улучшая значение надира тромбоцитов и снижая длительность их восстановления.
Уменьшение выраженности тромбоцитопении было также связано со снижением потребности в переливании тромбоцитов во время четырех циклов химиотерапии у пациентов, которые получали рчТП с –5-го дня (три дозы до/одна доза после курса химиотерапии или одна доза до/одна после) или с –7-го дня (четыре дозы до химиотерапии), по сравнению с пациентами, которые получали рчТП позже. Низкая потребность в переливании тромбоцитарной массы в когорте 5, пациенты которой получали рчТП только до начала химиотерапии (четыре дозы), представляет интерес, поскольку в этой когорте не было выявлено увеличения значений надира тромбоцитов во 2-м цикле химиотерапии. Тем не менее у них развилась менее выраженная кумулятивная тромбоцитопения в последующих циклах, что оценивалось по необходимости переливания тромбоцитов. Несмотря на то, что не до конца понятен механизм этого, можно предположить, что этот эффект связан с защитным влиянием рчТП, введенного до химиотерапии, на клетки-предшественники, который длился на протяжении последующих циклов химиотерапии. Он был реализован путем увеличения пула клеток- предшественников, снижения пролиферации посредством обратной связи, опосредованной увеличением количества тромбоцитов, или действуя в качестве фактора, препятствующего клеточной гибели [26–28].
Одним из наиболее неожиданных результатов данного исследования было то, что только две дозы рчТП в низких дозах (1,2 мкг/кг), вводимых однократно за 5 дней до химиотерапии и однократно по окончании химиотерапии, оказались достаточными для достижения хорошего клинического эффекта. В исследовании не было доказано преимущество более высоких доз или более частого введения рчТП. На самом деле, несмотря на увеличение надира тромбоцитов в цикле 2, наблюдалась тенденция к увеличению потребности в трансфузии тромбоцитарной массы у пациентов, получавших многократные дозы рчТП (три до/три после химиотерапии). Возможным объяснением этого факта может быть то, что длительная стимуляция рчТП после химиотерапии может задержать либо созревание мегакариоцитов, либо высвобождение тромбоцитов, либо оба процесса одновременно [29, 30]. Однако учитывая небольшой размер выборки в данном исследовании, необходимы масштабные испытания для того, чтобы определить, могут ли дополнительные дозы рчТП обеспечить дополнительное клиническое преимущество.
Лечение с помощью рчТП хорошо переносится, и никакие неблагоприятные побочные эффекты не связаны с его использованием, кроме одного случая тромбоза глубоких вен. Ни у одного пациента в этом исследовании не появились нейтрализующие антитела к рчТП, полноразмерной гликозилированной молекулы.
Таким образом, данные указывают на важность времени введения рчТП относительно химиотерапии с целью получения оптимальных результатов. Назначение рчТП только после химиотерапии может быть достаточным для снижения выраженности тромбоцитопении после коротких схем или схем, которые вызывают позднее развитие надира тромбоцитов (такие как карбоплатин), что было доказано ранее [20]. Тем не менее при применении более длительных и более интенсивных схем химиотерапии, особенно тех, что вызывают ранний и выраженный тромбоцитарный надир, введение рчТП как до химиотерапии, так и после может быть необходимым для достижения максимального клинического эффекта. В настоящее время продолжаются рандомизированные клинические испытания для дальнейшего определения важности кратности и сроков использования рчТП после многих режимов химиотерапии.
Благодарность
Мы благодарим Уолтера Н. Хиттлмана, доктора философии, за рецензирование рукописи, Каролин Хайс – за сбор и упорядочивание данных, Шона Д. Радж за помощь в анализе и Марджилинн Уайт за помощь в подготовке рукописи.
Литература
- McCullough J: Current issues with platelet transfusion in patients with cancer. Semin Hematol 37:3-10, 2000 (suppl 4)
- Slichter SJ: Optimizing platelet transfusions in chronically thrombocytopenic patients. Semin Hematol 35:269-278, 1998
- Pisciotto PT, Benson K, Hume H, et al: Prophylactic versus therapeutic platelet transfusion practices in hematology and/or oncology patients. Transfusion 35:498-502, 1995
- Schiffer CA, Anderson KC, Bennett CL, et al: Platelet transfusion for patients with cancer: Clinical Practice Guidelines of the American Society of Clinical Oncology. J Clin Oncol 19:1519-1538, 2001
- Vadhan-Raj S, Kudelka AP, Garrison L, et al: Effects of interleukin-1 alpha on carboplatin-induced thrombocytopenia in patients with recurrent ovarian cancer. J Clin Oncol 12:707-714, 1994
- Biesma B, Willemse PH, Mulder NH, et al: Effects of interleukin-3 after chemotherapy for advanced ovarian cancer. Blood 80:1141-1148, 1992
- Veldhuis GJ, Willemse PH, Sleijfer DT, et al: Toxicity and efficacy of escalating dosages of recombinant human interleukin-6 after chemotherapy in patients with breast cancer or non– small-cell lung cancer. J Clin Oncol 13:2585-2593, 1995
- Vadhan-Raj S, Papadopoulos NE, Burgess MA, et al: Effects of PIXY321, a granulocytemacrophage colony-stimulating factor/interleukin-3 fusion protein, on chemotherapy-induced multilineage myelosuppression in patients with sarcoma. J Clin Oncol 12:715-724, 1994
- D’Hondt V, Weynants P, Humbler Y, et al: Dose-dependent interleukin-3 stimulation of thrombopoiesis in patients with small-cell lung carcinoma before and following chemotherapy: A placebo-controlled randomized phase Ib study. J Clin Oncol 11:2063-2071, 1993
- Tepler I, Elias L, Smith JW, et al: A randomized placebo-controlled trial of recombinant human interleukin-11 in cancer patients with severe thrombocytopenia due to chemotherapy. Blood 87:3607-3614, 1996
- Isaacs C, Robert NJ, Bailey FA, et al.: Randomized placebo-controlled study of recombinant human interleukin-11 to prevent chemotherapyinduced thrombocytopenia in patients with breast cancer receiving doseintensive cyclophosphamide and doxorubicin. J Clin Oncol 15:3368-3377, 1997
- de Sauvage FJ, Hass PE, Spencer SD, et al: Stimulation of megakaryocytopoiesis and thrombopoiesis by the c-Mpl ligand. Nature 369:533-538, 1994
- Kuter DJ, Beeler DL, Rosenberg RD: The purification of megapoietin: A physiological regulator of megakaryocyte growth and platelet production. Proc Natl Acad Sci U S A 91:11104-11108, 1994
- Kaushansky K, Lok S, Holly RD, et al: Promotion of megakaryocyte progenitor expansion and differentiation by the c-Mpl ligand thrombopoietin. Nature 369:568-571, 1994
- Fanucchi M, Glaspy J, Crawford J, et al: Effects of polyethylene glycol-conjugated recombinant human megakaryocyte growth and development factor on platelet counts after chemotherapy for lung cancer. N Engl J Med 336:404-409, 1997
- Vadhan-Raj S, Murray LJ, Bueso-Ramos C, et al: Stimulation of megakaryocyte and platelet production by a single dose of recombinant human thrombopoietin in patients with cancer. Ann Intern Med 126:673-681, 1997
- Basser RL, Rasko JEJ, Clarke K, et al: Randomized, blinded, placebo-controlled phase I trial of pegylated recombinant human megakaryocyte growth and development factor with filgrastim after dose-intensive chemotherapy in patients with advanced cancer. Blood 89:3118-3128, 1997
- Vadhan-Raj S, Patel S, Broxmeyer HE, et al: Phase I-II investigation of recombinant human thrombopoietin (rhTPO) in patients with sarcoma receiving high dose chemotherapy (CT) with adriamycin (A) and ifosfamide (I). Blood 88:448a, 1996 (suppl 1, abstr 1779)
- Schiffer CA, Miller K, Larson RA, et al: A double-blind, placebocontrolled trial of pegylated recombinant human megakaryocyte growth and development factor as an adjunct to induction and consolidation therapy for patients with acute myeloid leukemia. Blood 95:2530-2535, 2000
- Vadhan-Raj S, Verschraegen CF, Bueso-Ramos C, et al: Recombinant human thrombopoietin attenuates carboplatin-induced severe thrombocytopenia and the need for platelet transfusions in patients with gynecologic cancer. Ann Intern Med 132:364-368, 2000
- Chu E, DeVita VT: Chemotherapeutic and biologic drugs, in Physicians’ Cancer Chemotherapy Drug Manual. Sudbury, MA, Jones and Bartlett Publishers, 2001, pp 37-476
- Chu E, Mota A, Nabbout N, et al: Common chemotherapy regimens in clinical practice, in Physicians’ Cancer Chemotherapy Drug Manual. Sudbury, MA, Jones and Bartlett Publishers, 2001, pp 501-580
- Patel S, Vadhan-Raj S, Burgess M, et al: Results of two consecutive trials of dose-intensive chemotherapy with doxorubicin and ifosfamide in patients with sarcomas. Am J Clin Oncol 21:317-321, 1998
- Crawford J, Ozer H, Stoller R, et al: Reduction by granulocyte colony-stimulating factor of fever and neutropenia induced by chemotherapy in patients with small-cell lung cancer. N Engl J Med 325:164-170, 1991
- Neumunaitis J, Robinowe S, Singer J, et al: Recombinant granulocytemacrophage colonystimulating factor after autologous bone marrow transplantation for lymphoid cancer. N Engl J Med 324:1773-1778, 1991
- Borge OJ, Ramsfjell V, Veiby OP, et al: Thrombopoietin, but not erythropoietin promotes viability and inhibits apoptosis of multipotent murine hematopoietic progenitor cells in vitro. Blood 88:2859-2870, 1996
- Ritchie A, Vadhan-Raj S, Broxmeyer HE: Thrombopoietin suppresses apoptosis and behaves as a survival factor for the human growth factordependent cell line, M07e. Stem Cells 14:330-336, 1996
- Wlodarski P, Wasik M, Ratajczak MZ, et al: Role of p53 in hematopoietic recovery after cytotoxic treatment. Blood 91:2998-3006, 1998
- Nagasawa T, Osada M, Komero T, et al: In vitro and in vivo deprivation of thrombopoietin induces megakaryocytic apoptosis and regulates platelet production. Exp Hematol 25:897, 1997 (abstr 591)
- Zauli G, Vitale M, Falcieri E, et al: In vitro senescence and apoptotic cell death of human megakaryocytes. Blood 90:2234-2243, 1997
c Journal of Clinical Oncology is the property of American Society of Clinical Oncology and its content may not be copied or emailed to multiple sites or posted to a listserv without the copyright holder’s express written permission. However, users may print, download, or email articles for individual use.
Journal of Clinical Oncology, Vol 21, No 16 (August 15), 2003: pp 3158-3167. DOI: 10.1200/JCO.2003.08.003.